
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
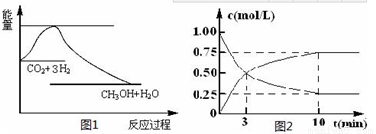
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=_________;
②下列措施中能使化学平衡向正反应方向移动的是___________(填字母)。
A.升高温度B.将CH3OH(g)及时液化抽出C.选择高效催化剂D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:_____________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极的电极反应式是:______________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年安徽省淮北市高一下学期第一次月考化学试卷(解析版) 题型:选择题
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色(已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀),则下列叙述正确的是( )。
A. 原溶液中的Br-可能未被氧化
B. 反应后的溶液中是否含有Fe2+可以用氯水和KSCN溶液检验
C. 取所得溶液加入CCl4后静置分液,向上层溶液中加入足量AgNO3溶液,能产生黄色沉淀
D. 反应后的溶液中一定不存在Fe2+
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次模拟化学卷(解析版) 题型:实验题
实验室用图示装置制备KClO溶液,再与KOH、F e(NO3)3溶液反应制备高效净水剂K2FeO4。
e(NO3)3溶液反应制备高效净水剂K2FeO4。
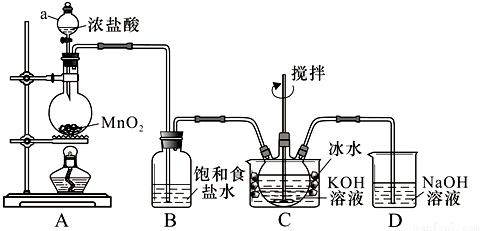
<查阅资料>Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;
K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)仪器a的名称: ;装置C中三颈瓶置于冰水浴中的目的是 。
(2)装置B吸收的气体是 ,装置D的作用是 。
(3)C中得到足量KClO 后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为 。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为 。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中。
②过滤。
③ 。
④搅拌、静置、过滤,用乙醇洗涤2~3次。
⑤在真空干燥箱中干燥。
(5)称取提纯后的K2FeO4样品0.2200 g于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀 硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL。涉及主要反应为:
硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL。涉及主要反应为:
Cr(OH)4-+FeO42- = Fe(OH)3↓+CrO42-+OH-
2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
Cr2O72-+6Fe2++14H+ = 6Fe3++2Cr3++7H2O
则该K2FeO4样品的纯度为 。
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次模拟化学卷(解析版) 题型:选择题
甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系。下列有关物质的推断不正确的是
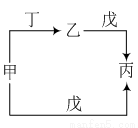
A.若甲为Na,则戊可能是H2O
B.若甲为C2H4,则戊可能是O2
C.若甲为NO,则戊可能是H2O
D.若甲为Cl2,则戊可能是NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g)  xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2
xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2
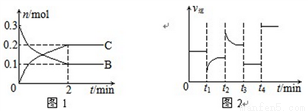
下列有关说法正确的是
A. x=2,反应开始2 min内,v(A)=0.05 mol/(L·min)
B. t1时改变的条件是降温,平衡逆向移动
C. t2时改变的条件可能是增大C的浓度,t2时正反应速率减小
D. t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列化学用语中,正确的是
A. NH4+的水解反应离子方程式:NH4++H2O NH3•H2O+H+
NH3•H2O+H+
B. 在AgCl悬浊液中加入KI溶液充分振荡:Ag++I-=AgI↓
C. 镀铜时,阳极的电极反应式为:Cu2++2e-═Cu
D. 某反应△H<0,则该反应在任意条件下均可自发进行
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三下学期期初联考化学试卷(解析版) 题型:简答题
钛白粉(金红石晶型 TiO2)被广泛用于制造高级白色油漆。工业上以钛铁矿(主要成分为 FeTiO3,含有 Fe2O3 和 SiO2 等杂质)为原料制钛白粉的主要工艺如下:
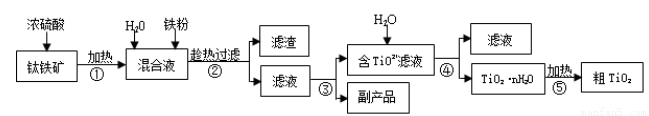
回答下列问题:
(1)第②步所得滤渣的成分是________。
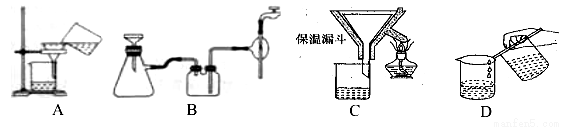
(2)操作④中需要控制条件以形成 TiO2·nH2O 溶胶,该工艺过程若要在实验室里完成,其中的“过滤”操作,可选用下列装置________(填选项)。
(3)第③步的实验操作是______、过滤,从而获得副产品 FeSO4·7H2O。
(4)为测定操作③所得滤液中TiO2+的浓度,取待测滤液10 mL 用蒸馏水稀释至100 mL,加入过量铝粉,充分振荡,使其完全反应:3TiO2+ + Al + 6H+ = 3Ti3+ + Al3+ + 3H2O。过滤后,取出滤液20.00 mL(加铝粉时引起溶液体积的变化忽略不计),向其中滴加2~3 滴KSCN溶液作指示剂,用 0.1000 mol·L-1NH4Fe(SO4)2 标准溶液滴定至溶液出现红色,此时溶液中 Ti3+全部被氧化为 Ti4+,消耗标准液30.00mL。回答下列问题:
①下列操作会使所测 TiO2+浓度偏高的是______。
A. 在配制标准液的过程中,未洗涤烧杯和玻璃棒
B. 在配制标准液定容是俯视刻度线
C.用蒸馏水洗涤后未经润洗的滴定管取待测液
D.在滴定终点读数时仰视滴定管刻度线
②求得待测滤液中 TiO2+的物质的量浓度是______。
(5)科学家从电解冶炼铝的工艺中得到启发,找出了冶炼钛的新工艺—TiO2 直接电解法生产钛,电解质为熔融的氯化钙,原理如图所示。

写出阴极电极反应式___________。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三下学期第一次联考理综化学试卷(解析版) 题型:选择题
F2和Xe在一定条件下生成氧化性极强且极易与水反应的XeF2、XeF4和XeF6三种化合物。其中XeF4与H2O可以发生如下反应:6 XeF4+12H2O=2XeO3+4Xe↑+24HF+3O2↑。下列判断正确的是
A. 上述反应中氧化剂和还原剂的物质的量之比为l:2
B. XeF4按以上方式与水反应,每生成3molO2转移12mol电子
C. XeF2加入水中,在水分子的作用下,将重新生成Xe和F2
D. XeF2、XeF4和XeF6在空气中都能长期存放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com