
【题目】祖母绿是四大名贵宝石之一,主要成分为Be3Al2Si6O18,含有微量的Cr、Ni、Fe元素而呈现各种颜色。回答下列问题:
(1)基态Ni2+的电子排布式为_______________;宝石中Si的杂化方式是____。
(2)成键元素电负性差值越大,化学键离子性百分数越高,在卤素与Al组成的化合物中,离子性百分数最高的化合物是______(填化学式)。
(3)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是______,加热Cr(CO)6可得到高纯度铬粉和CO,反应破坏的作用力类型为_________。
(4)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用Δ表示),它与中心离子的结构、电荷、配体有关。试判断分裂能Δ[Fe(H2O)63+] _____ Δ[Fe(H2O)62+](填“>”“<”或“=”),理由是___________________________。
(5)①氧化镍晶胞如图甲所示,A的原子坐标参数为:(0,0,![]() ),则底面面心B的原子坐标参数为_______________。
),则底面面心B的原子坐标参数为_______________。

②按图乙所示无限拓宽延长,NiO可形成“单层分子”,氧离子和镍离子均看着球体,其半径分别为a pm、b pm,“单层分子”截割出的最小重复结构单元在空间呈长方体,则离子在长方体内的空间利用率为____________(列出计算式即可)。
【答案】1s22s22p63s23p63d8(或[Ar]3d8) sp3 AlF3 分子晶体 配位键 > Fe3+的正电荷数比Fe2+的多,吸引电子能力更强;Fe3+的3d达到半充满稳定结构,Fe2+的3d未达到半充满稳定结构 (![]() ,
,![]() ,0)
,0) 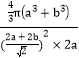 ×100%=
×100%=![]() ×100%=
×100%=![]() ×100%
×100%
【解析】
(1)镍为28号元素,结合核外电子排布规律书写基态Ni2+的电子排布式;Si原子与周围的4个原子形成共价键,没有孤电子对,据此判断硅原子的杂化方式;
(2)根据成键元素电负性差值越大,化学键离子性百分数越高,元素的非金属性越强,电负性数值越大,据此分析解答;
(3)根据六羰基铬[Cr(CO)6]的沸点为220℃,分析判断;加热Cr(CO)6可得到高纯度铬粉和CO,反应过程中破坏了中心原子与配体之间的作用力;
(4)配离子所带正电荷越多,对电子的吸引力越大,d-d电子跃迁需要的能量越多;
(5)①图甲中A位于晶胞棱的中点,据此判断底面面心B的原子坐标参数;
②图乙中,该晶胞单元中含有氧离子个数=10,镍离子个数为4+4×![]() +10×
+10×![]() =10,相邻两个氧离子之间的距离为
=10,相邻两个氧离子之间的距离为![]() (2a+2b) pm,据此分析计算。
(2a+2b) pm,据此分析计算。
(1)镍为28号元素,基态Ni2+的电子排布式为1s22s22p63s23p63d8(或[Ar]3d8);Si原子与周围的4个原子形成共价键,没有孤电子对,杂化方式为sp3,故答案为:1s22s22p63s23p63d8(或[Ar]3d8);sp3;
(2)成键元素电负性差值越大,化学键离子性百分数越高,元素的非金属性越强,电负性数值越大,在卤素与Al组成的化合物中,离子性百分数最高的化合物为AlF3,故答案为:AlF3;
(3)六羰基铬[Cr(CO)6]的沸点为220℃,符合分子晶体熔沸点的一般规律,Cr(CO)6属于分子晶体;加热Cr(CO)6可得到高纯度铬粉和CO,反应过程中破坏了中心原子与配体之间的配位键,故答案为:分子晶体;配位键;
(4)Fe(H2O)62+带2个单位正电荷,而Fe(H2O)63+带3个单位正电荷,后者对电子吸引力更大,且Fe3+的3d达到半充满稳定结构,Fe2+的3d未达到半充满稳定结构,故分裂能△[Fe(H2O)63+]>△[Fe(H2O)62+],故答案为:>;Fe(H2O)62+带2个单位正电荷,而Fe(H2O)63+带3个单位正电荷,后者对电子吸引力更强,Fe3+的3d达到半充满稳定结构,Fe2+的3d未达到半充满稳定结构;
(5)①图甲中,原子坐标参数:A(0,0,![]() ),A位于晶胞棱的中点,则底面面心B的原子坐标参数为B(
),A位于晶胞棱的中点,则底面面心B的原子坐标参数为B(![]() ,
,![]() ,0),故答案为:(
,0),故答案为:(![]() ,
,![]() ,0);
,0);
②图乙中,该晶胞单元中含有氧离子个数=10,镍离子个数为4+4×![]() +10×
+10×![]() =10,相邻两个氧离子之间的距离为
=10,相邻两个氧离子之间的距离为![]() (2a+2b) pm,则晶胞的棱长分别为5×
(2a+2b) pm,则晶胞的棱长分别为5×![]() (2a+2b)pm和2×
(2a+2b)pm和2×![]() (2a+2b)pm,高为2a pm,则晶胞的体积为5×
(2a+2b)pm,高为2a pm,则晶胞的体积为5×![]() (2a+2b)pm×2×
(2a+2b)pm×2×![]() (2a+2b) pm×2a pm=10a(2a+2b)2 pm3,10个氧离子和10个镍离子的体积为10×
(2a+2b) pm×2a pm=10a(2a+2b)2 pm3,10个氧离子和10个镍离子的体积为10×![]() pm3,因此离子在长方体内的空间利用率为
pm3,因此离子在长方体内的空间利用率为![]() ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】常温下,CH3COOH和NH3·H2O的电离常数均为1.8×10-5mol·L-1。向20mL浓度均为0.1mol·L-1 NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的电导率与加入CH3COOH溶液的体积(V)关系如图所示。下列说法错误的是
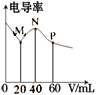
A. M点:c(Na+)>c(CH3COO-)>c(NH3·H2O)>c(NH4+)
B. 溶液呈中性的点处于N、P之间
C. 已知1g3≈0.5,P点的pH=5
D. P点:3[c(CH3 COO-)+ c(CH3COOH)]=2[ c(Na+)+c(NH4+)+c(NH3·H2O)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液中的酸碱度,AG=lg![]() 。25℃时,用0.100 mol·L-1的NaOH溶液滴定20.0 mL 0.100 mol·L-1某酸(HA)溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是
。25℃时,用0.100 mol·L-1的NaOH溶液滴定20.0 mL 0.100 mol·L-1某酸(HA)溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是
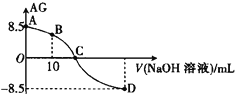
A. B点溶液中存在2c(H+)-2c(OH-)=c(A-)-c(HA)
B. C点时,加入NaOH溶液的体积大于20.00 mL
C. 滴定过程中应该选择甲基橙做指示剂
D. 25℃时,该酸HA的电离平衡常数Ka=1.0×10-5.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。 据此下列说法正确的是( )

A.该硫酸试剂的物质的量浓度为18.4 mol/L
B.稀释该硫酸时应把水倒入硫酸中,边倒边搅拌
C.标准状况下2.7 g Al与足量的该硫酸反应可得到H2 3.36 L
D.50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCO3可用于油漆、陶瓷和玻璃等工业。由方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2)制备PbCO3的流程如下:

已知:PbCl2难溶于冷水和乙醇,易溶于热水;各物质的溶度积见下表。试回答下列问题:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | PbCl2 | PbS | PbCO3 |
Ksp | 2×10-13 | 8.0×10-16 | 1×10-38 | 1.6×10-5 | 8.0×10-28 | 7.4×10-14 |
(1)PbCO3的名称是________。
(2)步骤①中MnO2的作用是________,根据下图分析①的最佳反应条件是________。

(3)步骤②趁热抽滤的原因是___________________。
(4)步骤③洗涤用的试剂是____________。
(5)将滤液Y先酸化,然后加入MnO2,反应的离子方程式为__________;若反应后c(Mn2+)=0.2mol/L,进一步调节溶液的pH可分离Fe3+和Mn2+,溶液所调的pH范围为_______[c(Fe3+)≤1×10-5 mol/L时表示Fe3+已沉淀完全]。
(6)步骤④反应的离子方程式为______________。
(7)样品PbCO3中有少量PbCl2杂质,提纯的实验方案是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeS、FeS2在酸性条件下都能与重铬酸钾(K2Cr2O7)溶液反应,还原产物为Cr3+,氧化产物都是Fe3+、SO42-。等物质的量FeS、FeS2完全反应时,消耗氧化剂的物质的量之比为
A.5:3B.9:17C.3:5D.3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1的某二元酸H2A溶液中,可能存在的含A粒子(H2A、HA-、A2-)的物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
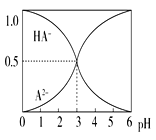
A. H2A的电离方程式:H2A![]() H++HA-
H++HA-
B. pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100
C. 等物质的量浓度的NaHA和Na2A溶液等体积混合, 离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+ 2c(H2A),各粒子浓度均大于0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平②烧杯③量筒④玻璃棒⑤容量瓶⑥胶头滴管⑦移液管
(2)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
以下为废水中铬元素总浓度的测定方法:_______________________
准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol·L-1的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 mL。计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O===Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+===2Cr3++3I2+7H2O
③I2+2S2O32-===2I-+S4O62-
(3)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
测定产品(Na2S2O3·5H2O)纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为:2S2O32-+I2===S4O62-+2I-
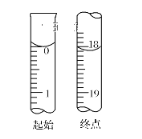
①滴定至终点时,溶液颜色的变化:________。
②滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为_________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑,判断能否设计成原电池A._____________,B._____________。(填“能”或“不能”)
(2)将纯锌片和纯铜片图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是_______________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲______________乙(填“>”、“<“或“=”)
③请写出图中构成原电池的负极电极反应式_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com