
某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,
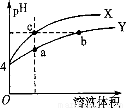
下列有关说法正确的是
A.加等量的水后硫酸中水电离出的C(H+)与硫酸铝中水电离出的C(H+)的比值比稀释前的比值增大
B.a点溶液中有:c(H+)+c(Al3+)=c(OH-)+c(SO42一)
C.体积和pH都相同的稀硫酸和硫酸铝溶液与等浓度的NaOH反应,消耗NaOH的体积相等
D.b、c两溶液水电离出的c(OH-)相等。
科目:高中化学 来源:2014-2015学年吉林省高三上学期第五次模拟考试理综化学试卷(解析版) 题型:选择题
分子式为C5H10O2的羧酸和酯,且有3个甲基的同分异构体共有(不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三第二次联考理综化学试卷(解析版) 题型:简答题
【化学–选修2:化学与技术】(15分)工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:

请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+2nHA(有机层) 2RAn(有机层)+nH2SO4 (水层)
2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)④的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 。
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有 和 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三综合能力测试(五)理综化学试卷(解析版) 题型:选择题
原子序数依次增大的X、Y、Z、R、W、T六种前20号元素,X、Y原子的最外层电子数与其电子层数相等,Y、T位于同族,R最外层电子数是次外层的3倍,W无正价,甲的化学式为ZX3,是一种刺激性气味的气体,乙是由X、Z、W组成的盐。下列说法正确的是
A.由X、Z、W组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度小于酸根离子浓度
B.气态氢化物的稳定性:W<R< Z
C.原子半径:W <Z<Y,而简单离子半径:Y<Z<W
D.ZR2、TR2两化合物中R的化合价相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三二模考试理综化学试卷(解析版) 题型:填空题
[化学——选修3]物质结构与性质:(15分)有A、B、C、D、E五种元素。其相关信息如下:

请回答下列问题。
(1)写出E元素原子基态时M层的电子排布式 。
(2)C元素单质分子中含有δ和∏键的键数之比为 。
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是: :C2A4分子中c原子轨 道的杂化类型是 。
(4)A、C、E三种元素可形成:【E(CA3)4】2+配离子,其中存在的化学键类型有 (填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若【E(CA3)4】2+具有对称的空间构型.且当【E(CA3)4】2+中的两个CA3分子被两个Cl一取代时.能得到两 种不同结构的产物,则【E(CA3)4】2+的空间构型为 (填序号)。
a.平面正方形 b.正四面体 c.三角锥型 d.V型
(5)B与D可形成离子化合物.其晶胞结构如图所示。其中D离子的配位数为 .若该晶体的密 度为a g·cm-3,则该晶胞中距离最近的B和D之间的距离是 cm(写出表达式即可,NA代表阿伏加得罗常数)
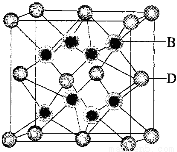
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三二模考试理综化学试卷(解析版) 题型:选择题
下列实验操作或叙述正确的是
A.通过导电实验证明氢氧化铁胶体带正电
B.除去苯中溶有的少量乙醇,加入水,振荡,然后分液
C.进行蒸馏操作时.应用温度计准确测量沸腾液体的温度
D.从海带中提取碘时用到的药品有双氧水和NaOH溶液
查看答案和解析>>
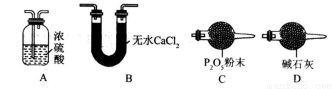
科目:高中化学 来源:2014-2015学年河北省高三下学期三调考试化学试卷(解析版) 题型:实验题
(15分)碱式碳酸钴 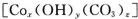 常用作电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示的装置进行实验。
常用作电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示的装置进行实验。
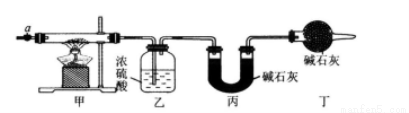
(1)请完成下列实验步骤:
①称取3.65 g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中_______(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通人空气数分钟的目的是___________________________________.
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的_______(填字母)连接在_______(填装置连接位置)。
(4)若按正确装置进行实验,测得如下数据。
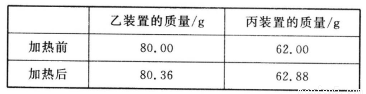
则该碱式碳酸钴的化学式为______________。
(5)含有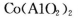 的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为_______。
的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为_______。
(6) 常用作多彩水泥的添加剂。以含钴废料(含少量Fe、Al等杂质)制取
常用作多彩水泥的添加剂。以含钴废料(含少量Fe、Al等杂质)制取 的一种工艺如下:
的一种工艺如下:

①净化除杂时,加入H2O2发生反应的离子方程式为____________________________.
②加入CoCO3 调pH为5.2~7.6,则操作1获得的滤渣成分为_____________________.
③加盐酸调整pH为2~3的目的为__________________________________________.
④操作Ⅱ过程为蒸发浓缩、______________(填操作名称)、过滤。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:选择题
根据原子结构及元素周期律的知识,下列推断正确的是
A.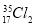 与
与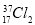 氧化能力相近,二者互为同位素
氧化能力相近,二者互为同位素
B.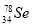 与
与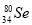 所含质子数相同,中子数不同
所含质子数相同,中子数不同
C.同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱
D.同周期主族元素形成的简单离子半径随核电荷数的增大而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中不符合此条件的是( )
|
| A. | CH4、C2H4 | B. | CH4 、C3H6 | C. | C2H4、C3H4 | D. | C2H2、C3H6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com