
用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项
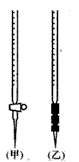
|
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源:2017届湖北省高三上第四次质检化学试卷(解析版) 题型:填空题
CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为 。
②用CO、O2和固体电解质还可以制成如下图1所示的燃料电池,则电极d的电极反应式为 。
(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。
①在图示2的转化中,化合价不变的元素是 (填元素名称)。
②在转化过程中通入氧气发生反应后,溶液的pH将 (填“增大” 、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为 。
、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为 。
③加入NaClO时发生的反应为:Cu(NH3) +2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
+2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有 、 。

图3
(3)CO与SO2在铝矾土作催化剂、773 K条件下 反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式: 。
反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
已知:可逆反应N2(g)+3H2(g)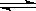 2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1molN2(g)和3molH2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2molNH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是
2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1molN2(g)和3molH2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2molNH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是
A.达平衡时甲中NH3的体积分数为75%
B.达平衡时甲、乙中NH3的体积分数乙>甲
C.达到平衡后,再向乙中加入0.25molN2(g)、0.75molH2(g)和1.5molNH3(g),平衡向生成NH3的方向移动
D.乙中反应的热化学方程式为2NH3(g)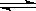 N2(g)+3H2(g);△H=+Q2kJ/mol
N2(g)+3H2(g);△H=+Q2kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:实验题
现进行实验,测定草酸晶体(H2C2O4·xH2O)中的x值;
(1)称取Wg草酸晶体,配成100.00mL溶液
(2)取25.00mL所配溶液于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定至KMnO4不再褪色为止,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
①本实验中,必需要用的仪器有(从下列仪器中选择,填序号)__________________,还缺少的仪器有(填名称):_______________________。
A、托盘天平(带砝码、镊子)
B、滴定管
C、100mL的量筒
D、100mL的容量瓶
E、烧杯
F、漏斗
G、锥形瓶
H、玻璃棒
I、药匙
J、烧瓶
②标准液KMnO4溶液应装在__________式滴定管中。
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,则所测得的x的值会__________(填偏大、偏小、无影响)。
④在滴定过程中若用去amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为_________mol·L-1,由此,x=__________。
⑤若滴定终点读数时仰视刻度,则计算的x值会__________(填偏大、偏小、无影响)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
下列各组离子中.在溶液里能大量共存,且溶液为无色透明的是
A.NH4+、NO3-、Al3+CL-
B.Na+、SiO32-、NO3-、Fe3+
C.Na+、MnO4-、K+、SO42-
D.Na+、HCO3-、SO42-、Al3+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
在恒温恒容的密闭容器中反应:aA(g) bB(g)+cC(g)达到化学平衡后,再充入一定量的A物质,重新达到平衡时,下列判断正确的是
bB(g)+cC(g)达到化学平衡后,再充入一定量的A物质,重新达到平衡时,下列判断正确的是
A.若a=b+c时,B的物质的量分数变大 B.若a=b+c时,B的物质的量分数变小
C.若a>b+c时,A的转化率不变 D.若a<b+c时,A的转化率变小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:填空题
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L 0.l mol/L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中
[c(CH3COO-)·c(H+)]/c(CH3COOH) (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4-9之间。土壤中Na2CO3含量较高,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ,加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为
(3)常温下在20ml 0.1mo l·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如图所示。

回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为 ,溶液中各种离子的物质的量浓度的大小关系
为 ;
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4mol·L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH= ;
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:选择题
根据下表提供的数据,判断下列离子方程式或化学方程式正确的是
化学式 | 电离常数 |
HClO | K=3×10-8 |
H2CO3 | K1=4×10-3 K2=6×10-11 |
A.向Na2CO3溶液中滴加少量氯水:CO32-+2Cl2+H2O=2Cl-+2HClO+CO2↑
B.向NaHCO3溶液中滴加少量氯水:2HCO3-+CI2=CI-+CIO-+2CO2↑+H2O
C.向NaClO溶液中通入少量CO2:CO2+NaClO+H2O=NaHCO3+HClO
D.向NaClO溶液通过量CO2:CO2+2NaClO+H2O=Na2CO3+2HClO
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn), 发生反应:Sn(s)+Pb2+(aq)  Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
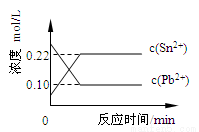
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com