
分析 (1)①根据配制一定物质的量浓度的溶液的操作步骤判断:在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤;
②锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+恰好还原成Fe2+;
③根据物质的性质和书写离子方程式的有关要求书写离子方程式;
④根据离子方程式计算,n(Fe)=5n(MnO4-)=5×$\frac{20.02ml+19.98ml}{2}$×0.01mol•L-1×10-3×10=1.0×10-2mol,m(Fe)=56 g•mol-1×1.0×10-2mol=0.56g.晶体中铁的质量分数=$\frac{0.56g}{5g}$×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高;
(2)加热后的晶体要在干燥器中冷却,防止重新吸收空气中的水分.另外在加热时至少要称量两次质量差,到两次称量质量差不超过0.1 g;
解答 解:(1)①在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤;
故答案为:溶解;定容;
②加入锌粉的目的是将Fe3+恰好还原成Fe2+,
故答案为:将Fe3+恰好还原成Fe2+;
③在步骤三中发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
④根据步骤三中的离子反应可知:n(Fe)=5n(MnO4-)=5×$\frac{20.02ml+19.98ml}{2}$×0.01 mol•L-1×10-3×10=1.0×10-2mol,m(Fe)=56 g•mol-1×1.0×10-2mol=0.56g.晶体中铁的质量分数为:$\frac{0.56g}{5g}$×100%=11.20%,
若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高,
故答案为:11.20%;偏高;
(2)加热后的晶体要在干燥器中冷却,防止重新吸收空气中的水分.另外在加热时至少要称量两次质量差,到两次称量质量差不超过0.1 g,
故答案为:加热后的晶体要在干燥器中冷却; 两次称量质量差不超过0.1 g.
点评 本题考查探究物质组成、测量物质含量的方法,题目难度中等,涉及到溶液的配制、滴定和结晶等操作、质量分数的计算等知识,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题.


科目:高中化学 来源: 题型:填空题
 在一密闭容器中发生反应N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
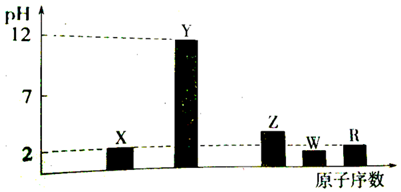
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
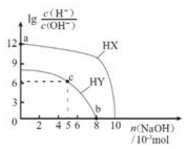 溶液的酸碱性可用酸度(AG)表示[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$],室温下,向浓度均为0.1mol/L体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,AG随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
溶液的酸碱性可用酸度(AG)表示[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$],室温下,向浓度均为0.1mol/L体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,AG随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )| A. | HX、HY均为弱酸 | |
| B. | a点由水电离出的c(H+)=1.0×l0-13mol•L-l | |
| C. | c点溶液中:c(Y-)<c(Na+)<c(HY) | |
| D. | b点时,溶液的pH=7,酸碱恰好完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
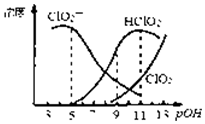 亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用.已知POH=-lgc(OH-),经测定25℃时各组分含量随POH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )
亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用.已知POH=-lgc(OH-),经测定25℃时各组分含量随POH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | PH=7时,溶液中含氯微粒的浓度大小:c(ClO2-)>c(HClO2)>c (ClO2) | |
| C. | HClO2的电离平衡常数的数值Ka=10-6 | |
| D. | 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有2c(HClO2)+c(H+)=2c(ClO2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 电解质溶液的电导率越大,导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度 均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温 Ksp[(CH3)2NH•H2O3=1.6×l04),利用传感器测得滴定过程中溶液的电导率如图所示》下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度 均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温 Ksp[(CH3)2NH•H2O3=1.6×l04),利用传感器测得滴定过程中溶液的电导率如图所示》下列说法正确的是( )| A. | b、c、d三点的溶液中水的电离程度:b<d<c | |
| B. | a 点溶液中:c(Na+)=2c(OH-)-2c(H+) | |
| C. | d 点溶液中:c[(CH3)2NH2+]+c(H+)-(OH-)=0.100mol•L-1 | |
| D. | e 点溶液中:c(H+)>c[(CH3)2NH2+]+2c[(CH3)2NH•H2O] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com