
| A. | Al3++3HCO${\;}_{3}^{-}$=Al(OH)3↓+3CO2↑ | B. | Al3++3H2O?Al(OH)3+3H+ | ||
| C. | NH4++2H2O?NH3•H2O+H3O+ | D. | HCO${\;}_{3}^{-}$+H2O?H3O++CO${\;}_{3}^{2-}$ |
分析 在盐中有弱酸根离子或弱碱离子时,与水电离产生的氢离子或氢氧根离子结合生成弱电解质,则发生的反应为盐类的水解反应.
解答 解:A、A13++3HCO3-=Al(OH)3↓+3CO2↑是A13+和3HCO3-发生相互促进的水解反应,属于水解反应,故A不选;
B、铝离子铵为弱离子,结合水电离产生的OH-,水解反应为Al3++3H2O?Al(OH)3+3H+,所以属于水解反应,故B不选;
C、铵根离子为弱碱离子,结合水电离产生的OH-,水解反应为NH4++2H2O?NH3•H2O+H3O+,所以属于水解反应,故C不选;
D、碳酸氢根离子属于弱离子,水解得到碳酸和氢氧根离子,该式子是碳酸氢根离子的电离方程式,不是水解方程式,故D选.
故选D.
点评 本题考查水解的原理,明确盐中的构成及“有弱才水解的规律”即可解答,注意离子结合水电离产生的氢离子或氢氧根离子结合生成弱电解质是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向KI溶液滴加氯水和CCl4振荡,静置后分层且下层显紫色,则氧化性:Cl2>I2 | |
| B. | 用丁达尔实验可以将Al(OH)3胶体和NaCl溶液区分开 | |
| C. | 明矾和漂白粉均可用于自来水的杀菌、消毒 | |
| D. | Al(OH)3与稀H2SO4、NaOH溶液均能反应,说明AI(OH)3是两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S-诱抗素的分子结构 中含有苯环、羟基、羰基、羧基(提示: 中含有苯环、羟基、羰基、羧基(提示: 是羰基) 是羰基) | |
| B. | 1mol阿司匹林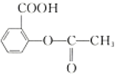 可与2molNaOH发生反应 可与2molNaOH发生反应 | |
| C. | 食品香精菠萝酯的生产路线(反应条件略去)如下图,步骤(2)产物中残留的烯丙醇可用溴水检验: | |
| D. | 有机物A为茉莉香型香料.已知 ,则A的分子式为C14H18O ,则A的分子式为C14H18O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 108:1 | C. | 5×109:1 | D. | 1010:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 化学反应A2(g)+B2(g)=2AB(g) 的能量变化如图所示,下列叙述中正确的是( )
化学反应A2(g)+B2(g)=2AB(g) 的能量变化如图所示,下列叙述中正确的是( )| A. | 每生成2mol AB(g) 共吸收b kJ热量 | |
| B. | 该反应热△H=+(a-b) kJ•mol-1 | |
| C. | 反应物的总能量大于生成物的总能量 | |
| D. | 断裂1 mol A-A键,放出a kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置有多种用途,请回答下列问题:
如图所示装置有多种用途,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
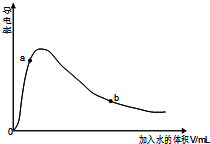 醋酸是中学常用的一种弱酸.
醋酸是中学常用的一种弱酸.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com