
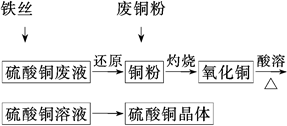
 2Cu+CO2↑或CuO+CO
2Cu+CO2↑或CuO+CO Cu+CO2
Cu+CO2 2CuSO4+2H2O
2CuSO4+2H2O 2CuSO4+2H2O;若用浓硫酸来溶解,发生反应Cu+2H2SO4(浓)
2CuSO4+2H2O;若用浓硫酸来溶解,发生反应Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,其缺点是生成等量硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2。
CuSO4+SO2↑+2H2O,其缺点是生成等量硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源:不详 题型:问答题
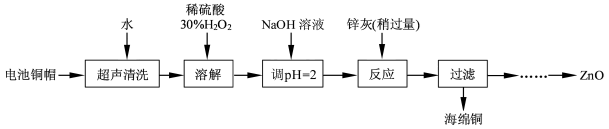
| | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Fe2+ | 5. 8 | 8. 8 |
| Zn2+ | 5. 9 | 8. 9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.三种实验方案都能制得纯净的铜 |
| B.乙方案中加过量铁粉可以将四种阳离子全部还原 |
| C.甲方案中的反应涉及置换、分解、化合、复分解四种反应类型 |
| D.丙方案会产生环境污染 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
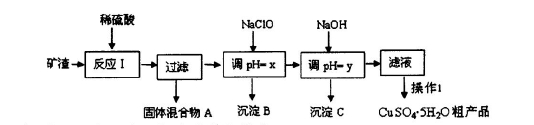
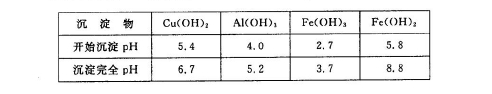
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
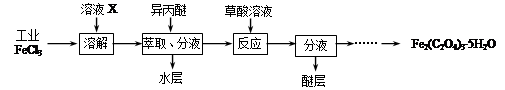

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该浅绿色溶液中含有Fe2+,在空气中被氧化为Fe3+ |
| B.欲检验该黄色溶液中是否含有未被氧化的Fe2+,向其中滴加KSCN溶液 |
| C.配制该浅绿色溶液,要向其中加少量酸与铁粉,目的是为了防止Fe2+的水解与氧化 |
| D.欲检验浅绿色溶液中是否含有Fe3+,滴入KSCN溶液,看是否变红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.25mol/L | B.2mol/L | C.0.3mol/L | D.0.6mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.蒸发皿 | B.石棉网 | C.烧杯 | D.玻璃棒 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 实验项目 | 实验现象 |
| FeCl3溶液中加入维生素C(VC) | 溶液褪色为浅绿色 |
| 饱和FeCl3溶液滴入沸水中 | 得到红褐色液体 |
| 将铜锈放入盐酸中 | 有无色气泡产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com