


 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
 (2007?淄博三模)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸.某化学研究小组在实验室中按下列步骤模拟该生产过程.填写下列空白:
(2007?淄博三模)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸.某化学研究小组在实验室中按下列步骤模拟该生产过程.填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
 对金属表面进行处理,形成一层致密的氧化物保护膜,是非常有效的一种金属防腐技术.
对金属表面进行处理,形成一层致密的氧化物保护膜,是非常有效的一种金属防腐技术.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
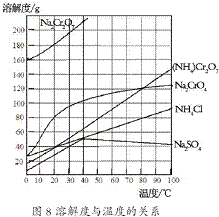 (2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:
(2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:2- 3 |
2- 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某过氧化钙样品的组成,进行了如下实验。
① 称取0.270 g样品,灼热使之完全分解,生成CaO、O2和H2O,得到的O2在标准状况下体积为33.6 mL。
② 另取0.120 g样品,溶于稀盐酸,加热煮沸,使生成的H2O2完全分解。然后将溶液中的Ca2+ 完全转化为CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.0200 mol·L-1 KMnO4溶液滴定,共用去31.0 mL KMnO4溶液。化学方程式如下:
5CaC2O4+2KMnO4+8H2SO4 = K2SO4+2MnSO4+5CaSO4+10CO2↑+8H2O
(1) 写出CaO2受热分解的化学方程式。
(2) 计算样品中CaO2的质量分数。
(3) 计算样品中CaO2·x H2O的x值。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com