
【题目】已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,下列说法正确的是 ( )
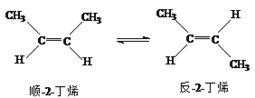 △H= -4.2 kJ/mol
△H= -4.2 kJ/mol
A. 反-2-丁烯和顺-2-丁烯具有相同的熔沸点。
B. 顺-2-丁烯比反-2-丁烯更稳定。
C. 加压和降温有利于平衡向生成顺-2-丁烯反应方向移动
D. 反-2-丁烯和顺-2-丁烯的核磁共振氢谱都有两个峰。
科目:高中化学 来源: 题型:
【题目】德国化学家哈伯(F. Haber, 1868-1930)发明的合成氨技术使大气中的氮气变成了生产氮肥的永不枯竭的廉价来源,从而使农业生产依赖土壤的程度减弱,解决了地球上因粮食不足导致的饥饿和死亡问题。因此这位解救世界粮食危机的化学天才获得了 1918年诺贝尔化学奖。现在我们在实验室模拟工业制氨的过程,以探究外界条件对平衡的影响。
查阅资料,获得以下键能数据:
化学键 | N≡N | H-H | N-H |
键能/(kJ/mol) | 946 | 436 | 391 |
(1)计算工业合成氨反应的反应热:N2(g)+3H2(g) ![]() 2NH3(g) △H=________ kJ/mol
2NH3(g) △H=________ kJ/mol
(2)一定温度下,向一个恒压容器中充入N20.6mol,H2 0 .5mol,在一定温度下进行反应:N2(g)+3H2(g) ![]() 2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
①该温度时容器中平衡体系的平衡常数是______________。
②若保持平衡时的温度和压强不变,继续向平衡体系中通入0.9mol N2,则平衡将____(填“正向”,“逆向”或“不”)移动。
(3)在两个压强相等,温度分别为T1和T2的容器中充入由1 mol N2和3 molH2组成的混合气体,发生反应N2(g)+3H2(g) ![]() 2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是______________
2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是______________

a.A、 B、 C三点的平衡常数大小关系:KA<KB<KC
b.B点和C点的H2浓度大小关系:B<C
c.A点和B点混合气体的密度大小关系:A<B
d.A点和C点混合气体的平均相对分子质量大小关系:A>C
(4)合成氨工业会产生大量副产物CO2,工业上常用高浓度的K2CO3溶液吸收CO2,,得溶液X,再利用电解法K2CO3溶液再生,其装置如图所示:

①在阳极区发生的反应包括____________________和H++ HCO3-=H2O+CO2↑。
②简述CO32-在阴极区再生的原理________________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
2H2(g)+ O2(g)=2H2O(g) Δ H1=-484kJ/mol
2CH3OH(g)+3 O2(g)=2CO2 (g)+4H2O(g) Δ H2=-1352kJ/mol
写出CO2和H2生成1molCH3OH(g)的热化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:

(1)写出元素k的基态原子的电子排布式________________________________,其原子核外有________个未成对电子。
(2)单质c在空气中充分燃烧的产物的分子构型为________ ,中心原子的杂化方式为_______,该分子含有________(填“极性键”或“非极性键”),该分子是________分子(填“极性”或“非极性”)。
(3)上述元素的最高价氧化物的水化物中,酸性最强的是___________________,碱性最的___________________(填化学式)。(每空1分)
(4)d的气态氢化物与d的最高价氧化物的水化物反应的离子方程式是:___________________________________________________________________________________________________________________________________。
(5)o、p两元素的部分电离能数据列于下表:比较两元素的I2、I3可知,气态o2+再失去一个电子比气p2+再失去一个电子困难。对此,你的解是__________________________________________________________________________。
元素 | o | P | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |

(6)短周期某主族元素的电离能情况如上图所示,则元素是上述周期表的__________元素(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色酸性溶液中能大量共存的一组离子是( )
A.Na+、K+、HCO3﹣、NO3﹣
B.NH4+、SO42﹣、Al3+、NO3﹣
C.Na+、Ca2+、NO3﹣、CO32﹣
D.K+、MnO4﹣、NH4+、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103 mol·L1 。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
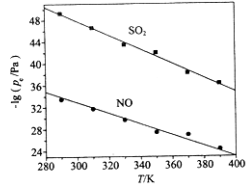
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ===SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B两份混合气体,A是烯烃R与足量O2的混合气体;B是烯烃R、炔烃Q与足量O2的混合气体。取A、B各2.24L分别引燃,A充分燃烧后气体总体积仍为2.24L,B充分燃烧后气体总体积为2.34L(燃烧后的产物均为气态,其体积已换算成标准状况)。通过计算,写出:
(1)烯烃R的分子式____________________。
(2)炔烃Q的分子式____________________。
(3)求2.24L B中烯烃R所允许的最大体积是_________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com