
| A、Na2SO3溶液中通入CO2溶液变浑浊,继续通入CO2至过量,浑浊消失 |
| B、均不能采取将溶液直接蒸干的方法制得AlCl3、Al2( SO4)3、Fe Cl3、Fe2( SO4)3 |
| C、Na、Mg、Cl是海水中的重要元素,从海水中制备这三种元素单质的反应都定存在氧化还原反应 |
D、元素X的单质及元素X与Y形成的化合物能按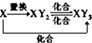 关系发生转化,则X可为Fe或S 关系发生转化,则X可为Fe或S |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
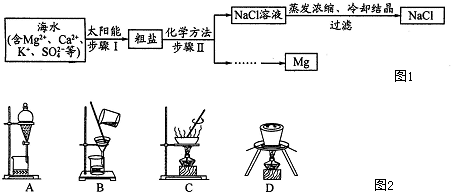
| Bacl2 |
| ① |
| NaOH |
| ② |
| Na2CO3 |
| ③ |
| HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当金属全部溶解时收集到NO气体的体积为2.24L(标准状况) |
| B、当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL |
| C、原稀硝酸的物质的量浓度一定为4mol/L |
| D、参加反应金属总质量(m)为9.6g>m>3.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1.0 | 17.8 | 20.0 | 22.4 | ||||
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A、pH=7的血液中,c(HCO3-)>c(H2CO3) | ||||
| B、正常体温下人体发生碱中毒时,c(H+)?c(OH-)变大 | ||||
| C、人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
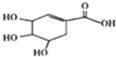
| A、分子式为C7H10O5 |
| B、1mol莽草酸与足量金属钠反应生成2molH2 |
| C、可发生加成反应、取代反应、氧化反应 |
| D、在水溶液中羧基和羟基均能电离出H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2(SO4)3溶液中加入过量Fe粉 |
| B、A1(OH)3中加入过量NaOH溶液 |
| C、浓H2SO4中加入过量Cu片,加热 |
| D、Ca(C1O)2溶液中通入过量CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
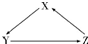 X、Y、Z为中学化学常见物质,其转化关系如下图所示(“→”表示一步转化).下列组合不正确的是( )
X、Y、Z为中学化学常见物质,其转化关系如下图所示(“→”表示一步转化).下列组合不正确的是( )| 选项 | X | Y | Z |
| A | SiO2 | H2SiO3 | Na2SiO3 |
| B | Na | Na2O2 | NaOH |
| C | H2SO3 | SO2 | H2SO4 |
| D | HClO | Cl2 | HCl |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验拟作 | 实验目的或结论 |
| A | 向某溶液中加人稀盐酸,放出无色剌激性气味气 体.将气体通人澄清石灰石灰水变混浊 | 证明该格液中存在SO 32- |
| B | 将NaOH溶液滴人该溶液中加热?放出的气体能使湿润的红色石蕊试纸变蓝 | 证明溶液中有NH4+ |
| C | 将Cl2,通人品红溶液中,品红溶液褪色 | 证明Cl2的还性 |
| D | 用毓酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明氧化性:H2O2比Fe3+ 强 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
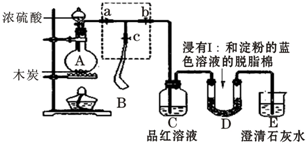
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com