
| 1 |
| 5 |
| 112 |
| 160 |
| 5×112(W2-W1) |
| 160a |
| 5×112(W2-W1) |
| 160a |


科目:高中化学 来源: 题型:

| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 112(W2-W1) |
| 160a |
| 112(W2-W1) |
| 160a |
查看答案和解析>>
科目:高中化学 来源:湖北省黄冈市2009—2010学年度高三年级期末考试理科综合能力测试化学试题 题型:实验题
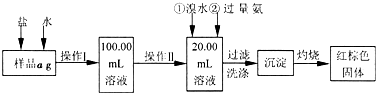
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯.玻璃棒.量筒外,还必须有____________ (填自选仪器名称),操作II必须用到的仪器是____________(填编号)。
| A.50mL烧杯 | B.50mL量筒 | C.25mL碱式滴定管 | D.25mL酸式滴定管 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省济宁市高三第二次质量检测化学试卷 题型:填空题
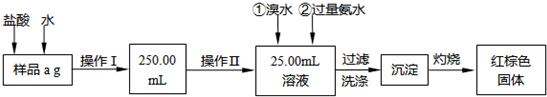
(15分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯.玻璃棒.量筒外,还必须有____________ (填仪器名称),操作II必须用到的仪器是____________(填编号)。
A.50mL烧杯 B.50mL量筒
C.25mL碱式滴定管 D.25mL酸式滴定管
(2)洗涤是洗去附着在沉淀上的____________。(写离子符号)
(3)检验沉淀是否已经洗涤干净的操作是________________________。
(4)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是_________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是____________。
(6)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是________________________。(用化学方程式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com