
【题目】铁单质及其化合物在生活、生产中应用广泛。请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为___________________。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是________________________________________________________________________。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是______________________________(用离子方程式表示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是______________________________。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是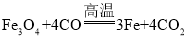 ,若有1.5mol Fe3O4参加反应,转移电子的物质的量是__________。
,若有1.5mol Fe3O4参加反应,转移电子的物质的量是__________。
【答案】O2 +4e-+2H2O=4OH- 2Fe3++Cu=Cu2++2Fe2+ Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ Fe3+水解导致溶液显酸性,而酸性环境中,H+抑制了Fe3+的水解,无法生成Fe(OH)3胶体 12mol
Fe(OH)3(胶体)+3H+ Fe3+水解导致溶液显酸性,而酸性环境中,H+抑制了Fe3+的水解,无法生成Fe(OH)3胶体 12mol
【解析】
(1)吸氧腐蚀时,正极O2得电子生成4OH-;
(2)FeCl3溶液与Cu反应生成CuCl2与FeCl2;
(3)Fe3+水解显酸性,据此分析作答;
(4)依据氧化还原反应的规律作答。
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为O2 +4e-+2H2O=4OH-;
(2)根据氧化剂的氧化性大于氧化产物的氧化性规律可知,FeCl3与铜板反应的离子方程式为:2Fe3++Cu=Cu2++2Fe2+;
(3)Fe3+水解生成的Fe(OH)3胶体具有净水作用,原理方程式为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,硫酸铁中由于Fe3+水解导致溶液显酸性,而酸性环境中,H+抑制了Fe3+的水解,无法生成Fe(OH)3胶体,所以硫酸铁不能使酸性废水中的悬浮物沉降而除去;
Fe(OH)3(胶体)+3H+,硫酸铁中由于Fe3+水解导致溶液显酸性,而酸性环境中,H+抑制了Fe3+的水解,无法生成Fe(OH)3胶体,所以硫酸铁不能使酸性废水中的悬浮物沉降而除去;
(4)氧化还原反应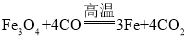 中,1mol Fe3O4参加反应,转移电子的物质的量是8mol,所以有1.5mol Fe3O4参加反应,转移电子的物质的量是12mol。
中,1mol Fe3O4参加反应,转移电子的物质的量是8mol,所以有1.5mol Fe3O4参加反应,转移电子的物质的量是12mol。


科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用.已知pOH=﹣lgc(OH﹣),经测定25℃时各组分含量随pOH变化情况如图所示(Cl﹣没有画出),此温度下,下列分析正确的是
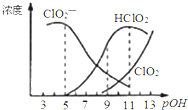
A.HClO2的电离平衡常数的数值Ka=10﹣6
B.亚氯酸钠在酸性条件下较稳定
C.pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2﹣)>c(ClO2)>c(Cl﹣)
D.同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)-2c(H+)=c(ClO2﹣)-2c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下图:
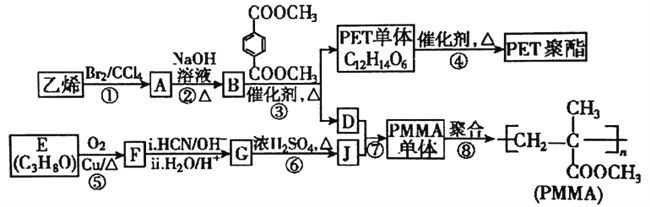
已知:
I.RCOOR+R "OH![]() RCOOR "+ROH (R.R'、R"代表烃基)
RCOOR "+ROH (R.R'、R"代表烃基)
II.  (R代表烃基)。
(R代表烃基)。
(1)PMMA单体的结构简式为_______,PET单体中的官能团名称为________。
(2)反应⑤的反应类型是________;反应②的化学方程式为_________。
(3)若反应④得到的某一条链状产物聚合度为n,则缩聚反应中脱去的小分子有(___)个。
(4)PMMA单体有多种同分异构体,某种异构体K具有如下性质:①不能发生银镜反应②不能使溴水褪色③分子内没有环状结构④核磁共振氢谱有面积比为3:1的两种峰,则K的结构简式为:__________;另一种异构体H含有醛基、羟基和碳碳双键,在铜催化下氧化,官能团种类会减少一种,则H合理的结构共有___种(不考虑立体异构和空间异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL某浓度的盐酸中,混合物完全溶解,当再加入250mL 2.00mol/L的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为( )
A. 1.00 mol/LB. 0.500 mol/L
C. 2.00 mol/LD. 3.00 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态,铈的合金耐高温,可以用来制造喷气推进器零件。
请回答下列问题:
(1)雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1:1),该反应氧化剂与还原剂的物质的量之比为________。
(2)可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的______(填字母序号)口流出。
②写出阴极的电极反应式________________。
(3)铈元素在自然界中主要以氟碳矿形式存在。主要化学成分为CeFCO3。工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下:

①焙烧过程中发生的主要反应方程式为__________________。
②有同学认为酸浸过程中用稀硫酸和H2O2替换盐酸更好,他的理由是_________。
③Ce(BF4)3、KBF4的Ksp分别为a、b,则Ce(BF4)3(s)+3KCl(aq)![]() 3KBF4(s)+CeCl3(aq)平衡常数为________(用a、b的代数式表示)。
3KBF4(s)+CeCl3(aq)平衡常数为________(用a、b的代数式表示)。
④加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学教师为 “氯气与金属钠反应”设计了如图装置的实验。实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是( )

A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C. 钠着火燃烧产生苍白色火焰
D. 发生的反应为2Na+Cl2![]() 2NaCl
2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
② R-CH=CH2![]() R-CH2-CH2-Br
R-CH2-CH2-Br
香豆素的核心结构是芳香内酯A,A经下列步骤转变为水杨酸。
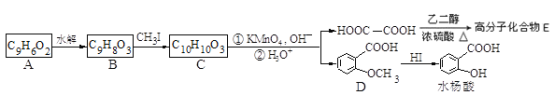
请回答下列问题:
(1)下列有关A、B、C的叙述中不正确的是___________
a. C中核磁共振氢谱共有8种峰
b. A、B、C均可发生加聚反应
c. 1mol A最多能和5mol氢气发生加成反应
d. B能与浓溴水发生取代反应
(2)B分子中有2个含氧官能团,分别为______和______(填官能团名称),B→C的反应类型为_____________。
(3)在上述转化过程中,反应步骤B→C的目的是_________________________。
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的对二取代物,且水解后生成的产物之一能发生银镜反应。请写出其中一种的结构简式:_____________。
(5)写出合成高分子化合物E的化学反应方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用少量的溴和足量的乙醇制备1,2—二溴乙烷,反应原理为:CH3CH2OH![]() CH2=CH2↑+H2O;CH2=CH2+Br2→BrCH2CH2Br。制备装置如图所示:
CH2=CH2↑+H2O;CH2=CH2+Br2→BrCH2CH2Br。制备装置如图所示:

下列说法中不正确的是( )
A. 使用恒压低液漏斗的目的是防止有机物挥发,使漏斗内液体顺利滴下
B. 实验中为了防止有机物大量挥发,应缓慢升高反应温度至170℃
C. 装置C中应加入氢氧化钠溶液,以吸收反应中可能生成的酸性气体
D. 实验过程中应用冷水冷却装置D,以避免溴的大量挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH)。下列说法正确的是( )
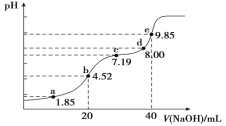
A.a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1 mol/L
B.b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C.c点所得溶液中:c(Na+)>3c(HSO3-)
D.d点所得溶液中:c(Na+)>c(OH-) >c(SO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com