
分析 (1)该反应KClO3中Cl元素化合价由+5价变为0价、HCl中Cl元素化合价由-1价变为0价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物、氧化剂对应的产物是还原产物,HCl在反应中部分发生氧化还原反应做还原剂,部分化合价不变生成盐表现了酸性,据此分析解答;
(2)在反应KClO3+6HCl(浓)=KCl+3H2O+3Cl2↑中6molHCl反应电子转移6mole-;
(3)依据化学方程式定量关系计算;
解答 解:(1)在反应KClO3+6HCl(浓)=KCl+3H2O+3Cl2↑中,该反应KClO3中Cl元素化合价由+5价变为0价、HCl中Cl元素化合价由-1价变为0价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物、氧化剂对应的产物是还原产物,所以KClO3是氧化剂、还原产物是Cl2、HCl是还原剂、氧化产物是Cl2,HCl在反应中部分发生氧化还原反应做还原剂,部分化合价不变生成盐表现了酸性,故答案为:KClO3;Cl2;还原;酸;
(2)在反应KClO3+6HCl(浓)=KCl+3H2O+3Cl2↑中6molHCl反应电子转移5mole-,若有3mol HCl参加反应,则上述反应中转移的电子数为2.5mol,
故答案为:2.5;
(3)若反应生成标准状况下的Cl2体积为33.6L,n(Cl2)=$\frac{33.6L}{22.4L/mol}$=1.5mol,依据化学方程式计算需要的氯酸钾物质的量,则需消耗KClO3的质量=nM计算得到,
KClO3+6HCl(浓)=KCl+3H2O+3Cl2↑
1 3
n 1.5mol
n=0.5mol
消耗KClO3的质量=0.5mol×122.5g/mol=61.25g,
故答案为:61.25g;
点评 本题考查了氧化还原反应概念判断、电子转移计算,主要是化学方程式的定量计算,注意氧化还原反应中氯元素化合价变化和电子转移总数的计算,掌握基础是解题关键,题目较简单.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| B. | 蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水也不溶解 | |
| C. | 浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应 | |
| D. | 人工合成的具有生命活性的蛋白质-结晶牛胰岛素,是1965年我国科学家最先合成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时,用细沙覆盖灭火 | |
| B. | 金属钠与氧气反应,条件不同,产物不同 | |
| C. | Na的化学性质比镁活泼,故用Na与MgCl2溶液反应制取金属镁 | |
| D. | 9.2g金属钠与足量水反应,反应过程中有0.4mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
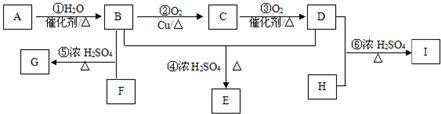
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
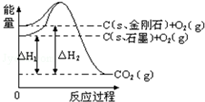
| A. | 金刚石的稳定性强于石墨 | |
| B. | 12g石墨总键能比12g金刚石小1.9kJ | |
| C. | 石墨和金刚石的转化是物理变化 | |
| D. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
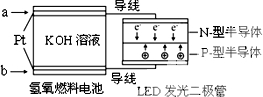 LED产品的使用为城市增添色彩.如图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
LED产品的使用为城市增添色彩.如图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )| A. | 该装置将化学能最终转化为电能 | |
| B. | a处通入O2 | |
| C. | b处为电池正极,发生还原反应 | |
| D. | 通入O2的电极上发生的电极反应为O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1CaCl2溶液中含氯离子数为0.2 NA | |
| B. | 0.1 mol铁粉与过量的氯气完全反应,转移电子数为0.2NA | |
| C. | 标准状况下,2.24 L H2O所含的原子总数为0.3 NA | |
| D. | 常温常压下,17g NH3含有的电子个数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
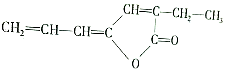 ,该物质在现代工业合成中大有用途,请回答下列有关该物质的问题:
,该物质在现代工业合成中大有用途,请回答下列有关该物质的问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | A | B | C | D |
| 物质类型 | 离子化合物 | 共价键直接构成的物质 | 共价分子 | 稀有气体 |
| 代表物质 | NaCl | 金刚石 | 干冰 | Ne |
| 组成晶体的结构微粒 | Na+、Cl- | C | CO2 | Ne |
| 结构微粒间相互作用 | 离子键 | 共价键 | 分子间作用力 | 共价键 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com