
| ��Ӧʱ��/min | n��SO2��/mol | n��O2��/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A����ͬ�¶��£���ʼʱ�������г���0.050mol SO2��0.030mol O2���ﵽƽ��ʱSO2ת����С��88% | ||
| B�����������������䣬��ʼʱ�������г���0.10mol SO3��0.010 mol O2������ƽ��ʱ��n��SO2��=0.0012 mol | ||
| C�����������������䣬�����¶ȣ�ƽ��ʱc��SO2��=0.0070mol?L-1����Ӧ�ġ�H��0 | ||
D����Ӧ��0��t1 min�ڵ�ƽ������Ϊv��SO3��=
|
| 0.088mol |
| 0.1mol |
| 0.088mol |
| 0.1mol |
| 0.012mol |
| 2L |
| ||
| t1 |
| 0.044 |
| t1 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��Ӧʱ��/min | n��SO2��/mol | n��O2��/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A����Ӧ��ǰ5min��ƽ������Ϊv��SO2��=0.08mol?L-1 min-1 |
| B�������¶Ȳ��䣬��ƽ�����������ٳ���1molSO2��0.5molO2ʱ��v��������v���棩 |
| C�����������������䣬����ʼʱ�������г���2molSO3����ƽ��ʱ����78.4kJ������ |
| D����ͬ�¶��£���ʼʱ�������г���1.5mol SO3����ƽ��ʱSO3��ת����Ϊ40% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���¶�ʱ�����ݻ�Ϊ2L���ܱ������г���һ������SO2��O2��������Ӧ��2SO2��g��+O2��g��?2SO3��g������Ӧ�����вⶨ�IJ������ݼ��±�������t1��t2��������˵����ȷ���ǣ�������
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ���и�����ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���¶�ʱ�����ݻ�Ϊ2L���ܱ������г���һ������SO2��O2��������Ӧ2SO2(g)+O2(g)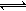 2SO3(g)
∆H��−196kJ��moL−1��һ��ʱ����ƽ�⣬��Ӧ�����вⶨ�IJ������ݼ��±���
2SO3(g)
∆H��−196kJ��moL−1��һ��ʱ����ƽ�⣬��Ӧ�����вⶨ�IJ������ݼ��±���
|
��Ӧʱ��/min |
n(SO2)/mol |
n(O2)/mol |
|
0 |
2 |
1 |
|
5 |
1.2 |
|
|
10 |
|
0.4 |
|
15 |
0.8 |
|
����˵������ȷ����
A����Ӧ��ǰ5min��ƽ������Ϊv (SO2)=0.08mol��L−1 min−1
B�������¶Ȳ��䣬��ƽ�����������ٳ���1molSO2��0.5molO2ʱ��v (��)�� v (��)
C�����������������䣬����ʼʱ�������г���2molSO3����ƽ��ʱ����78.4kJ������
D����ͬ�¶��£���ʼʱ�������г���1.5mol SO3����ƽ��ʱSO3��ת����Ϊ40%
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com