
| A. | 工业上用水吸收NO2生产硝酸:3NO2+H2O═2HNO3+NO | |
| B. | 用氨水除去工业原料氯化铵中的氯化铁杂质:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 用熟石灰处理泄漏的液氯:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O | |
| D. | 用明矾除去水中的悬浮颗粒物:Al3++3H2O?Al(OH)3 (胶体)+3H+ |
分析 A.二氧化氮与水反应生成硝酸和NO气体;
B.一水合氨不能拆开,需要保留分子式;
C.氯气能够与氢氧化钙反应生成氯化钙、次氯酸钙和水;
D.铝离子水解生成氢氧化铝胶体,氢氧化铝胶体具有较大的表面积,能够净水.
解答 解:A.工业上用水吸收NO2生产硝酸,反应的化学方程式为3NO2+H2O=2HNO3+NO,故A正确;
B.用氨水除去工业原料氯化铵中的氯化铁杂质,反应生成氢氧化铁沉淀和氯化铵,正确的离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,故B错误;
C.用熟石灰处理泄漏的液氯,氢氧化钙与氯气反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,故C正确;
D.明矾除去水中的悬浮颗粒物,铝离子能够水解生成氢氧化铝胶体,反应的离子方程式为Al3++3H2O?Al(OH)3(胶体)+3H+,故D正确;
故选B.
点评 本题考查了化学方程式、离子方程式的书写判断,题目难度中等,注意掌握离子方程式、化学方程式的书写原则,B为易错点,注意一水合氨为弱电解质,离子方程式中不能拆开.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ①②⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
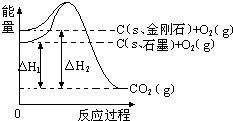
| A. | C(s、石墨)═C(s、金刚石)△H=+1.9kJ•mol-1 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 石墨的稳定性强于金刚石 | |
| D. | 1mol石墨的总键能比1mol金刚石的总键能小1.9kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 0.012kg12C含有约6.02×1023个碳原子 | |
| C. | 物质的量是国际单位制中七个基本物理量之一 | |
| D. | 在使用摩尔表示物质的量的单位时,应指明粒子的种类 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com