
| A. | 18 g H2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCO2含有的分子数目为NA | |
| C. | 1mol•L-1K2SO4溶液中含有的钾离子数目为2NA | |
| D. | 1mol H2在O2中完全燃烧转移的电子数目为NA |
分析 A.18g水的物质的量为1mol,含有2molH原子;
B.标况下22.4L二氧化碳的物质的量为1mol,根据N=nNA计算含有分子数;
C.缺少溶液体积,无法计算含有钾离子数目;
D.1mol氢气与氧气完全反应转移2mol电子.
解答 解:A.18g水的物质的量为:$\frac{18g}{18g/mol}$=1mol,1mol水分子中含有2mol氢原子,含有的氢原子数目为2NA,故A错误;
B.标准状况下,22.4LCO2的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,含有二氧化碳的分子数目为NA,故B正确;
C.没有告诉1mol•L-1K2SO4溶液的体积,无法计算硫酸钾的物质的量,故C错误;
D.1mol H2在O2中完全燃烧转移2mol电子,转移的电子数目为2NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,C为易错点,注意题中缺少溶液体积,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
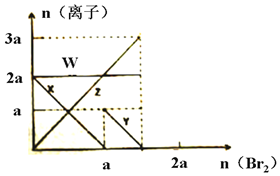 已知氧化性:Br2>Fe3+>I2,向amolFeI2和amolBaCl2的混合溶液中缓慢通入bmolBr2,并不断搅拌,溶液中离子的物质的量随Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化).则下列说法不正确的是( )
已知氧化性:Br2>Fe3+>I2,向amolFeI2和amolBaCl2的混合溶液中缓慢通入bmolBr2,并不断搅拌,溶液中离子的物质的量随Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化).则下列说法不正确的是( )| A. | 离子的还原性I->Fe2+>Br- | |
| B. | 四条线与溶液中离子的对应关系是:X-Fe2+、Y-I-、Z-Br-、W-Cl- | |
| C. | 当4a=3b时,反应后的离子浓度比:c(Fe2+):c(Fe3+)c:(Br-)=1:2:8 | |
| D. | 当3a≤2b时,发生的离子方程式:2Fe2++4I-+3Br2═2Fe3++2I2+6Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
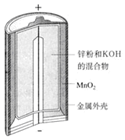 | 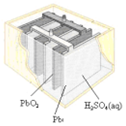 | 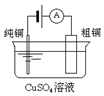 | 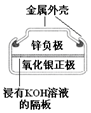 |
| 图Ⅰ碱性锌锰电池 | 图Ⅱ铅蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
| A. | 图Ⅰ所示电池中,锌为负极,MnO2的作用是催化剂 | |
| B. | 图II所示电池二氧化铅为正极,放电过程中硫酸浓度不变 | |
| C. | 图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 | |
| D. | 图IV所示电池工作过程中,Ag2O是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用焰色反应鉴别NaCl、KCl溶液 | |
| B. | 用氢氧化钠鉴别MgCl2溶液、AlCl3溶液 | |
| C. | 利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用澄清石灰水鉴别SO2、CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
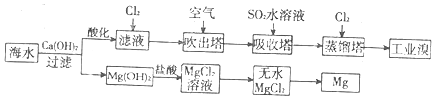
| A. | 若提取1 mol Br2,至少需要标准状况下44.8 L的Cl2 | |
| B. | 工业上常利用电解熔融MgCl2冶炼金属镁 | |
| C. | 富集溴元素过程中,空气吹出法利用了溴易挥发的性质 | |
| D. | 工业溴中含少量Cl2,可用氢氧化钠溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗0.8molNaClO3时,转移的电子数为0.8NA | |
| B. | H2O不是氧化产物,也不是还原产物,CO2是还原产物,ClO2是氧化产物 | |
| C. | 氧化剂和还原剂的物质的量之比为4:1 | |
| D. | 每生成1molCO2需转移24mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
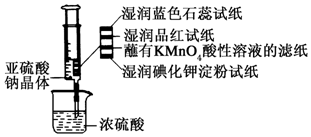 如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A. | 湿润的蓝色石蕊试纸只变红不褪色 | |
| B. | 湿润的品红试纸蘸有KMnO4酸性溶液的滤纸均褪色证明了SO2的漂白性 | |
| C. | 湿润的碘化钾淀粉试纸未变蓝说明SO2不能将I-还原为I2 | |
| D. | 实验后,可把注射器中的物质推入NaOH溶液,以减少环境污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com