
短周期非金属元素A、B、C的核电荷数依次增大,A原子的外围电子排布式为ns2np2,C是地壳中含量最多的元素。元素D、E都位于第四周期,其中E的核电荷数为29,D原子的核外未成对电子数在同周期中是最多的。请用对应的元素符号或化学式填空:
(1)元素A、B、C的第一电离能由小到大的顺序为________。
(2)已知(AB)2分子中键与键之间的夹角为180°,并有对称性,且每个原子的最外层电子数均满足8电子结构,则其结构式为________,1 mol该分子中含有的π键的数目为________。
(3)基态D原子的外围电子排布式为________。化合物DO2Cl2的熔点是-96.5 ℃,沸点是117 ℃,则固态DO2Cl2属于________晶体。

(4)已知元素E的氢化物的晶胞结构如上图所示,则其化学式为___________
(1)C<O<N (2)NCCN 4NA(或2.408×1024) (3)3d54s1 分子 (4)CuH
【解析】 由C是地壳中含量最多的元素知,C为O元素。又由A原子外围电子排布式ns2np2且核电荷数小于O元素知A为C元素,故B为N元素。由E的核电荷数为29,则E为Cu,D原子的核外未成对电子数在第四周期最多,则D为[Ar]3d54s1,故D为 Cr。(1)根据第二周期元素第一电离能递变规律和第ⅤA族电离能的特殊性知C、N、O元素的第一电离能由小到大为C<O<N。(2)由(CN)2的键角为180°,立体构型为直线形及对称性和8电子结构,得到(CN)2的结构式为NCCN,1 mol(CN)2中π键为4NA。(3)Cr的基态原子的外围电子排布式为3d54s1。由熔、沸点低知CrO2Cl2属于分子晶体。(4)由晶胞中Cu原子和H原子半径知原子半径大的为Cu,其数目为8×1/8+6×1/2=4,原子半径小的为H,其数目为4,故Cu的氢化物的化学式为CuH。


科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:选择题
在25 ℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是( )。

A.反应可表示为3X+Y 2Z
2Z
B.从反应开始到0.4 s时,以Y表示的化学反应速率为0.25 mol·L-1·s-1
C.增大压强使平衡向生成Z的方向移动,正逆反应速率均增大
D.升高温度,平衡常数一定增大
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第2讲化学常用计量练习卷(解析版) 题型:选择题
常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )。

A.硫酸溶液的体积为10 mL
B.b时刻溶液中SO42—的浓度约为0.125 mol·L-1
C.d时刻溶液的pH为13
D.溶液的导电能力:c<d<b<a
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第1讲物质的组成性质和分类练习卷(解析版) 题型:选择题
下列化学用语表示正确的是( )。
A.Cl-的结构示意图:
B.甲烷分子的球棍模型:
C.氢氧化钠的电子式: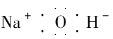
D.次氯酸的结构式:H—O—Cl
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第15讲实验化学练习卷(解析版) 题型:实验题
阿司匹林可由水杨酸与乙酸酐作用制得。其制备原理如下:


阿司匹林(乙酰水杨酸)的钠盐易溶于水。阿司匹林可按如下步骤制取和纯化:
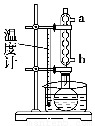
步骤1:在干燥的50 mL圆底烧瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡使水杨酸全部溶解。
步骤2:按图所示装置装配好仪器,通水,在水浴上加热回流5~10 min,控制水浴温度在85~90 ℃。
步骤3:反应结束后,取下反应瓶,冷却,再放入冰水中冷却、结晶、抽滤、冷水洗涤2~3次,继续抽滤得粗产物。
步骤4:将粗产物转移至150 mL烧杯中,在搅拌下加入25 mL饱和碳酸氢钠溶液,充分搅拌,然后过滤。
步骤5:将滤液倒入10 mL 4 mol·L-1盐酸,搅拌,将烧杯置于冰浴中冷却,使结晶完全。抽滤,再用冷水洗涤2~3次。
(1)步骤1浓硫酸的作用可能是________。
(2)步骤2中,冷凝管通水,水应从________口进(填“a”或“b”)。
(3)步骤3抽滤时,有时滤纸会穿孔,避免滤纸穿孔的措施是______________________________________________________________。
(4)步骤4发生主要反应的化学方程式为_____________________;过滤得到的固体为________。
(5)取几粒步骤5获得的晶体加入盛有5 mL水的试管中,加入1~2滴1%三氯化铁溶液,发现溶液变紫色,可采用________方法,进一步纯化晶体。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第13讲实验方案设计与评价练习卷(解析版) 题型:实验题
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+CCl4(g) TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:

有关物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
仪器A的名称是________。装置E中的试剂是________。反应开始前依次进行如下操作:组装仪器、________、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2 ②熄灭酒精灯 ③冷却至室温。正确的顺序为________(填序号)。欲分离D中的液态混合物,所采用操作的名称是________。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解 TiOSO4(aq)+2H2O(l) H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:

①试剂A为________。钛液Ⅰ需冷却至70 ℃左右,若温度过高会导致产品TiO2产率降低,原因是_________________________________________________
_______________________。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是________。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是____________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第12讲化学实验基础练习卷(解析版) 题型:选择题
下列有关实验操作、实验现象和结论都正确的是( )。
选项实验操作实验现象结论
A在Ba(NO3)2溶液中分别滴入H2SO3和H2SO4溶液均有白色沉淀 沉淀均为BaSO4
B混合装有Cl2和NH3两集气瓶中的气体产生大量白烟NH3显还原性和碱性
C溶液X中滴入盐酸酸化的FeCl3溶液,再滴入淀粉溶液溶液变蓝色溶液X中一定含有I-
D向浓度均为0.01 mol·L-1的NaCl和Na2S的混合溶液中滴入少量AgNO3溶液出现黑色沉淀 Ksp(Ag2S)> Ksp(AgCl)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第11讲有机化学基础练习卷(解析版) 题型:选择题
阿司匹林是日常生活中应用广泛的医药之一。它可由下列方法合成:

下列说法正确的是( )。
A.邻羟基苯甲醛分子中所有的原子不可能在同一平面
B.用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应①
C.反应②中加入适量的NaHCO3可提高阿司匹林的产率
D.与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有4种
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题8电化学基础练习卷(解析版) 题型:填空题
电解法在金属精炼、保护环境、处理废水中起着十分重要的作用。
(1)下图为电解精炼银的示意图,________(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为________________________。

AgNO3—HNO3溶液
(2)电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。回答下列问题:
①写出电极反应式:阴极________________,阳极________________。
②当生成1 mol Cr(OH)3时,电路中转移电子的物质的量至少为________mol。
③电解过程中有Fe(OH)3沉淀生成,原因是_________________________________________________________________
________________________________________________________________。
(3)电解降解法可用于治理水中硝酸盐的污染。电解降解NO3-的原理如图所示。

①电源正极为________(填A或B),阴极反应式为________________________________________________________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com