
【题目】盐类水解程度的大小可用“水解度”来表示,NaA型盐的水解度为已水解的离子的物质的量占该离子原来总物质的量的百分数。常温下10.0 mL 0.040 mol·L-1 NaOH溶液与20.0 mL 0.020 mol·L-1的某一元弱酸HA恰好完全中和,所得溶液pH为10(假设溶液的体积变化忽略不计),则所得NaA溶液的水解度为
A.1.0%B.0.75%C.0.50%D.0.25%
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是
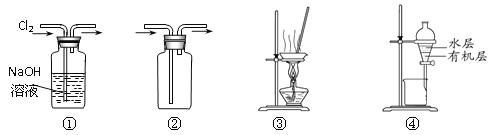
A.装置①可用于除去Cl2中含有的少量HCl气体
B.按装置②所示的气流方向可用于收集H2、NH3等
C.用图③所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
D.用图④所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
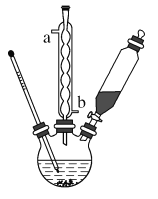
【题目】硫酰氯(SO2Cl2)是重要化学试剂,资料:(1)SO2Cl2:熔点-54.1℃,沸点:69.1℃,易水解,产生大量白雾;(2)制备原理:SO2(g)+Cl2(g)=SO2Cl2(g) H=-97.3kJ/mol。现用如图装置(夹持仪器已省略)进行实验,下列说法正确的是( )

A.A的作用是冷凝回流兼导气,冷水应b进a出
B.乙和丙中应该分别为饱和食盐水和浓硫酸
C.活性炭的作用有可能是为了加快反应速率
D.B中最好盛装碱石灰,其作用只是为了除去多余的SO2和Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各式中能正确表示水解反应的是
A.S2-+2H2O![]() H2S+2OH-B.NH4++H2O
H2S+2OH-B.NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
C.AlO2-+ HCO3-+H2O==Al(OH)3↓+ CO32-D.HCO3-+H2O![]() H3O++ CO32-
H3O++ CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠是一种常见食品防腐剂。实验室制备苯甲酸的装置图和有关数据如下:
相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
苯甲酸钠 | 144 | ---- | 249.3 | 易溶于水 |
(1)制备苯甲酸:在三颈烧瓶中加入4mL甲苯和20mL稀硫酸,放入碎瓷片后,加热至沸腾,加入12.8g高锰酸钾,加热到甲苯层消失。将三颈烧瓶在冰水浴中冷却,分离出苯甲酸。
①球形冷凝管的作用是_________,其进水口是________(填“a”或“b”)。
②已知三颈烧瓶中反应的离子方程式为![]() +6MnO4-+18H+→
+6MnO4-+18H+→![]() +6Mn2++14H2O,在该反应中体现了甲苯____性。
+6Mn2++14H2O,在该反应中体现了甲苯____性。
③分离苯甲酸选用的玻璃仪器除玻璃棒、烧杯外还有________(填字母)。
A.分液漏斗 B.漏斗 C.蒸馏烧瓶 D.直形冷凝管
④分离出粗品苯甲酸晶体中可能含有的杂质是MnSO4和___,为进一步提纯,应采用的操作方法是______。
(2)制备苯甲酸钠:控制温度为70℃,向三颈烧瓶中加入61.0g苯甲酸和适量的32%碳酸钠溶液,充分反应后停止加热。在深色的溶液中加入活性炭,并将混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体。
⑤控制温度为70℃的方法是_______。
⑥加入活性炭的作用是___________。
⑦若提纯得到46.8g苯甲酸钠,则苯甲酸钠的产率________。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种有机物的球棍模型如图(图中棍表示单键、双键或三键)。关于该有机物的说法正确的是

A.该球棍模型表示的化学式为C6H6
B.该有机物只能发生取代反应和加成反应两种反应
C.该有机物可使溴水褪色,但不能使酸性高锰酸钾溶液褪色
D.该有机物不是乙酸的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可能提高煤的利用率。煤的气化技术的主要产物是___________。煤的液化技术又分为直接液化和间接氧化.将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为___________。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放.
①在燃烧前,可以采用微生物脱硫技术.原理如下:
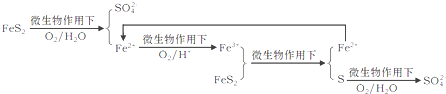
上述过程中Fe2+的作用为________________。写出Fe2+![]() Fe3+的离子方程式________________。
Fe3+的离子方程式________________。
②煤在燃烧时,进行脱硫处理,常采用________燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用.常用脱硫剂的主要化学成分为_______(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术.湿法脱硫、脱硝技术中将烟气通入_________设备,用石灰水淋洗。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25°C时,CH3COOH和NH3H2O的电离常数相等。取10mL0.1molL-1醋酸溶液测得其pH=3。 0.1molL-1氨水(NH3H2O溶液)的pH=_________。用pH试纸测定该氨水pH的操作方法为_______。
(2)某温度(t°C)时,测得0.01 molL-1的NaOH溶液的pH=11,则该温度下水的KW=_________。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,若所得混合液为中性,且a+b=12, 则Va: Vb_________。
(3)25°C时,0.1 molL-1的HA溶液中![]() 。请回答下列问题:
。请回答下列问题:
①HA是_________(填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是_________(填字母)。
a.c(HA) b.![]() c.c(H+)与c(OH-)的乘积 d.c(OH-)
c.c(H+)与c(OH-)的乘积 d.c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2的漂白能力是漂白粉的4~5倍, NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
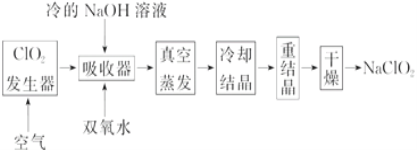
(1)ClO2发生器中的反应为:2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4。实际工业生产中,可用硫黄、浓硫酸代替原料中的SO2,其原因为_____________(用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:________________________。
(3)吸收器中生成NaClO2的离子反应方程式为___________________________________。
(4)某化学兴趣小组用如下图所示装置制备SO2并探究SO2与Na2O2的反应:
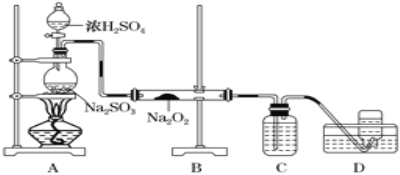
①盛放浓H2SO4仪器名称为_____,C中溶液的作用是____________。
②D中收集到的气体可使带余烬的木条复燃,B中发生的反应可能为__________、Na2O2+SO2=Na2SO4。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com