
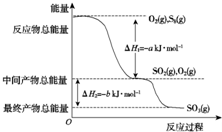
 在200℃下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用下图简单表示(图中的△H表示生成1mol含硫产物的数据).由图得出的结论正确的是( )
在200℃下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用下图简单表示(图中的△H表示生成1mol含硫产物的数据).由图得出的结论正确的是( )| A. | S8(s)的燃烧热△H=-8a kJ•mol-1 | |
| B. | 2SO3(g)═2SO2(g)+O2(g)△H=-2b kJ•mol-1 | |
| C. | S8(s)+8O2(g)═8SO2(g)△H=-a kJ•mol-1 | |
| D. | 由1 mol S8(s)生成SO2的反应热△H=-(a+b) kJ•mol-1 |
分析 A.依据燃烧热概念分析计算;
B.1molSO3分解吸收b kJ热量;
C.1molO2和$\frac{1}{8}$molS8反应生成二氧化硫放热aKJ;
D.1molS8(s)生成SO3(g)放出8(a+b)KJ热量.
解答 解:A.依据图象分析1molO2和$\frac{1}{8}$molS8反应生成二氧化硫放热aKJ/mol,依据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式为:S8(s)+8O2(g)=8SO2(g)△H=-8aKJ/mol,则S8(s)的燃烧热△H=-8akJ•mol-1,故A正确;
B.1molO2和$\frac{1}{8}$molS8反应生成二氧化硫放热aKJ,则2SO3(g)?2SO2(g)+O2(g);△H=+2b kJ•mol-1,故B错误;
C.1molO2和$\frac{1}{8}$molS8反应生成二氧化硫放热aKJ,则S8(s)+8O2(g)=8SO2(g);△H=-8a kJ•mol-1;故C错误;
D.1molS8(s)生成SO3(g)放出8(a+b)KJ热量,则由1molS8(s)生成SO3(g)的反应热△H=-8(a+b)kJ•mol-1,故D错误;
故选A.
点评 本题考查了反应能量变化的分析判断,焓变的计算应用,反应热和键能的计算关系应用,图象分析和概念理解是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
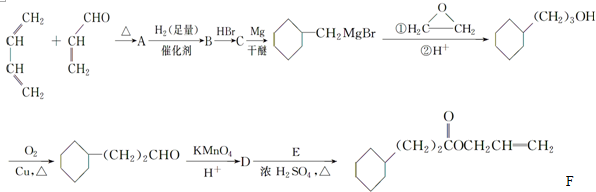
 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
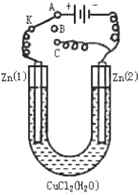 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图连接:
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图连接:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.| I1 | I2 | I3 | I4 | I5 | |
| I/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2H2(g)+O2(g)=2H2O(g )△H1 2H2(g)+O2(g)=2H2O(1)△H2 | |
| B. | S(g)+O2(g)=SO2(g )△H1 S(s)+O2(g)=SO2(g )△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO (g )△H1 C(s)+O2(g)=CO2 (g )△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g )△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g )△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化合物中呈现+2价 | B. | 氢氧化物呈强碱性 | ||
| C. | 单质与冷水不反应 | D. | 碳酸盐难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | - |
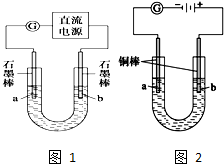
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com