
| A. | 砷元素的最高化合价为+3 | |
| B. | 砷的气态氢化物比NH3稳定 | |
| C. | 砷的最高价氧化物的水溶液呈强碱性 | |
| D. | 砷原子的第3电子层含有18个电子 |
分析 砷的原子结构示意图为: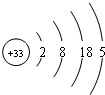 ,砷位于第四周期第ⅤA族,砷和氮元素处于同一主族,同一主族元素的性质具有相似性.
,砷位于第四周期第ⅤA族,砷和氮元素处于同一主族,同一主族元素的性质具有相似性.
解答 解:A.主族元素的最高化合价与其族序数相同(但O、F除外),所以砷的最高化合价是+5价,故A错误;
B.同主族从上到下非金属性逐渐减弱,氢化物的稳定性逐渐减弱,则砷的气态氢化物比NH3稳定弱,故B错误;
C.砷和氮元素处于同一主族,同一主族元素的性质具有相似性,所以砷的氧化物的水溶液呈酸性,故C错误;
D.根据原子示意图知,砷的第三电子层上有18个电子,故D正确;
故选:D.
点评 本题考查元素的原子序数及位置,明确元素在周期表中的位置及元素周期律即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | P、S、C1元素最高正价依次升高 | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 离子半径:Mg2+<Na+<F- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚2-甲基-1,3-丁二烯的结构简式: | B. | 间羟基苯甲酸的结构简式: | ||
| C. | N3-的结构示意图: | D. | 氯化钡的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电能转化为化学能 | B. | 电解质溶液是稀硫酸 | ||
| C. | 电子通过外电路从正极流向负极 | D. | Zn做负极被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+H2O=CO+H2;△H=+131.2KJ/mol | |
| B. | CO(g)+H2(g)=C(s)+H2O(g);△H=-131.2KJ/mol | |
| C. | C(s)+H2O(g)=CO(g)+H2(g);△H=+10.93KJ/mol | |
| D. | C(s)+H2O(g)=CO(g)+H2(g);△H=-131.2KJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com