
| ĪļÖŹĆū³Ę | ĘĻĢŃĢĒĖįøĘ | ĘĻĢŃĢĒĖį | äå»ÆøĘ | ĀČ»ÆøĘ |
| Ė®ÖŠµÄČܽāŠŌ | æÉČÜÓŚĄäĖ®Ņ×ČÜÓŚČČĖ® | æÉČÜ | Ņ×ČÜ | Ņ×ČÜ |
| ŅŅ“¼ÖŠµÄČܽāŠŌ | Ī¢ČÜ | Ī¢ČÜ | æÉČÜ | æÉČÜ |
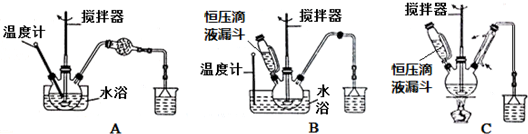
·ÖĪö ĘĻĢŃĢĒČÜŅŗÖŠ¼ÓČė3%äåĖ®”¢ĪĀ¶ČæŲÖĘŌŚ55”ę£¬ĪĀ¶ČŠ”ÓŚ100”ę£¬Ó¦øĆÓĆĖ®Ō”¼ÓČČ£¬ĒŅĪĀ¶Č¼Ę²āĮæĖ®Ō”ĪĀ¶Č£»
·¢ÉśµÄ·“Ó¦ĪŖCH2OH£ØCHOH£©4CHO+Br2+H2O”śC6H12O7£ØĘĻĢŃĢĒĖį£©+2HBr£¬øĆ·“Ó¦ÖŠÉś³ÉHBr£¬ĪŖ·ĄÖ¹ĪŪČ¾“óĘų£¬Ó¦øĆÓĆ¼īŅŗ“¦ĄķHBr£»Č»ŗóĻņČÜŅŗÖŠ¼ÓČė¹żĮæCaCO3”¢ĪĀ¶ČæŲÖĘŌŚ70”ę£¬·¢Éś·“Ó¦2C6H12O7£ØĘĻĢŃĢĒĖį£©+CaCO3”śCa£ØC6H11O7£©2£ØĘĻĢŃĢĒĖįøĘ£©+H2O+CO2”ü£¬ĘĻĢŃĢĒĖįøĘæÉČÜÓŚĄäĖ®Ņ×ČÜÓŚČČĖ®£¬ĖłŅŌ³ĆČČ¹żĀĖ£¬½«Ī“ČܽāµÄĢ¼ĖįøĘ³żČ„£¬Č»ŗóĻņĀĖŅŗÖŠ¼ÓČėŅŅ“¼£¬ĘĻĢŃĢĒĖįøĘĪ¢ČÜÓŚŅŅ“¼£¬ĖłŅŌµĆµ½ĘĻĢŃĢĒĖįøĘŠü×ĒŅŗ£¬Č»ŗó³éĀĖµĆµ½¹ĢĢå£¬Č»ŗóĻ“µÓ”¢øÉŌļ¹ĢĢå×īŗóµĆµ½Ca£ØC6H11O7£©2¹ĢĢ壻
£Ø1£©µŚ ¢Ł²½ÖŠäåĖ®Ńõ»ÆĘĻĢŃĢĒŹ±£¬øĆĪĀ¶ČŠ”ÓŚ100”ę£¬Ó¦øĆÓĆĖ®Ō”¼ÓČČ£»
£Ø2£©µŚ ¢Ś²½³ä·Ö·“Ó¦ŗóCaCO3¹ĢĢåŠčÓŠŹ£Óą£¬¹żĮæµÄĢ¼ĖįøĘÄÜĢįøßĘĻĢŃĢĒĖįµÄ×Ŗ»ÆĀŹ£»
£Ø3£©±¾ŹµŃéÖŠ²»ŅĖÓĆCaCl2Ģę“śCaCO3£¬ĀČ»ÆøĘŗĶĘĻĢŃĢĒĖį²»·“Ó¦£»
£Ø4£©µŚ¢Ū²½Šč³ĆČČ¹żĀĖ£¬ŅņĪŖĘĻĢŃĢĒĖįøĘŅ×ČÜÓŚČČĖ®£»
£Ø5£©ĘĻĢŃĢĒČÜŅŗÓėŠĀÖĘCu£ØOH£©2Šü×ĒŅŗ·¢ÉśŃõ»Æ·“Ӧɜ³ÉĘĻĢŃĢĒĖįÄĘ”¢Ńõ»ÆŃĒĶŗĶĖ®£®
½ā“š ½ā£ŗĘĻĢŃĢĒČÜŅŗÖŠ¼ÓČė3%äåĖ®”¢ĪĀ¶ČæŲÖĘŌŚ55”ę£¬ĪĀ¶ČŠ”ÓŚ100”ę£¬Ó¦øĆÓĆĖ®Ō”¼ÓČČ£¬ĒŅĪĀ¶Č¼Ę²āĮæĖ®Ō”ĪĀ¶Č£»
·¢ÉśµÄ·“Ó¦ĪŖCH2OH£ØCHOH£©4CHO+Br2+H2O”śC6H12O7£ØĘĻĢŃĢĒĖį£©+2HBr£¬øĆ·“Ó¦ÖŠÉś³ÉHBr£¬ĪŖ·ĄÖ¹ĪŪČ¾“óĘų£¬Ó¦øĆÓĆ¼īŅŗ“¦ĄķHBr£»Č»ŗóĻņČÜŅŗÖŠ¼ÓČė¹żĮæCaCO3”¢ĪĀ¶ČæŲÖĘŌŚ70”ę£¬·¢Éś·“Ó¦2C6H12O7£ØĘĻĢŃĢĒĖį£©+CaCO3”śCa£ØC6H11O7£©2£ØĘĻĢŃĢĒĖįøĘ£©+H2O+CO2”ü£¬ĘĻĢŃĢĒĖįøĘæÉČÜÓŚĄäĖ®Ņ×ČÜÓŚČČĖ®£¬ĖłŅŌ³ĆČČ¹żĀĖ£¬½«Ī“ČܽāµÄĢ¼ĖįøĘ³żČ„£¬Č»ŗóĻņĀĖŅŗÖŠ¼ÓČėŅŅ“¼£¬ĘĻĢŃĢĒĖįøĘĪ¢ČÜÓŚŅŅ“¼£¬ĖłŅŌµĆµ½ĘĻĢŃĢĒĖįøĘŠü×ĒŅŗ£¬Č»ŗó³éĀĖµĆµ½¹ĢĢå£¬Č»ŗóĻ“µÓ”¢øÉŌļ¹ĢĢå×īŗóµĆµ½Ca£ØC6H11O7£©2¹ĢĢ壻
£Ø1£©µŚ ¢Ł²½ÖŠäåĖ®Ńõ»ÆĘĻĢŃĢĒŹ±£¬øĆĪĀ¶ČŠ”ÓŚ100”ę£¬Ó¦øĆÓĆĖ®Ō”¼ÓČČ£¬Ö»ÓŠBŹĒĖ®Ō”¼ÓČČ£¬¹ŹŃ”B£»
£Ø2£©µŚ¢Ś²½³ä·Ö·“Ó¦ŗóCaCO3¹ĢĢåŠčÓŠŹ£Óą£¬¹żĮæµÄĢ¼ĖįøĘÄÜĢįøßĘĻĢŃĢĒĖįµÄ×Ŗ»ÆĀŹ£¬ĒŅĢ¼ĖįøĘ²»Ņ×ČÜÓŚĖ®£¬ĖłŅŌĢ¼ĖįøĘŅ׳żČ„£¬¹Ź“š°øĪŖ£ŗĢįøßĘĻĢŃĢĒĖįµÄ×Ŗ»ÆĀŹ£¬ĒŅ¹żĮæµÄĢ¼ĖįøĘŅ׳żČ„£»
£Ø3£©ŃĪĖįĖįŠŌ“óÓŚĘĻĢŃĢĒĖį£¬ĖłŅŌĀČ»ÆøĘŗĶĘĻĢŃĢĒĖį²»·“Ó¦£¬Ōņ±¾ŹµŃéÖŠ²»ŅĖÓĆCaCl2Ģę“śCaCO3£¬
¹Ź“š°øĪŖ£ŗĀČ»ÆøĘÄŃŅŌÓėĘĻĢŃĢĒĖįÖ±½Ó·“Ó¦ÖʵĆĘĻĢŃĢĒĖįøĘ£»
£Ø4£©µŚ¢Ū²½Šč³ĆČČ¹żĀĖ£¬ŅņĪŖĘĻĢŃĢĒĖįøĘŅ×ČÜÓŚČČĖ®£¬æÉČÜÓŚĖ®£¬ĖłŅŌŅŖ³ĆČČ¹żĀĖ£¬
¹Ź“š°øĪŖ£ŗĘĻĢŃĢĒĖįøĘĄäČ“ŗó»į½į¾§Īö³ö£¬Čē²»³ĆČČ¹żĀĖ»ņĖšŹ§²śĘ·£»
£Ø5£©ĘĻĢŃĢĒČÜŅŗÓėŠĀÖĘCu£ØOH£©2Šü×ĒŅŗ·¢ÉśŃõ»Æ·“Ӧɜ³ÉĘĻĢŃĢĒĖįÄĘ”¢Ńõ»ÆŃĒĶŗĶĖ®£¬
·“Ó¦·½³ĢŹ½ĪŖCH2OH£ØCHOH£©4CHO+2Cu£ØOH£©2+NaOH$\stackrel{”÷}{”ś}$CH2OH£ØCHOH£©4COONa+Cu2O”ż+3H2O£¬¹Ź“š°øĪŖ£ŗCH2OH£ØCHOH£©4CHO+2Cu£ØOH£©2+NaOH$\stackrel{”÷}{”ś}$CH2OH£ØCHOH£©4COONa+Cu2O”ż+3H2O£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹÖʱø·½°øÉč¼Ę£¬ĪŖøßĘµæ¼µć£¬×ŪŗĻŠŌ½ĻĒ棬Éę¼°ŹµŃé²Ł×÷”¢ĪļÖŹŠŌÖŹµČÖŖŹ¶µć£¬Ć÷Č·ŹµŃéŌĄķ¼°»ł±¾²Ł×÷·½·ØŹĒ½ā±¾Ģā¹Ų¼ü£¬×¢Ņā½įŗĻ±ķøńÖŠĪļÖŹŠŌÖŹ·ÖĪö½ā“š£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µĪ¼Ó·ÓĢŖ³ŹŗģÉ«µÄČÜŅŗ£ŗI-£¬ClO-£¬NO3-£¬Na+ | |
| B£® | ŗ¬ÓŠFe3+µÄČÜŅŗ£ŗK+£¬Mg2+£¬SCN-£¬HSO3- | |
| C£® | $\frac{Kw}{c£Ø{H}^{+}£©}$=0.1mol•L-1µÄČÜŅŗ£ŗNa+£¬K+£¬SiO32-£¬Br- | |
| D£® | ¼ÓAlÄÜÉś³ÉH2µÄČÜŅŗ£ŗNa+£¬K+£¬CO32-£¬Cl- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | pH=1µÄČÜŅŗÖŠ£ŗMg2+£¬CO${\;}_{3}^{2-}$£¬SO${\;}_{4}^{2-}$£¬Na+ | |
| B£® | c£ØFe3+£©=0.1mol•L-1µÄČÜŅŗÖŠ£ŗK+£¬SO${\;}_{4}^{2-}$£¬OH- | |
| C£® | Ź¹ŹÆČļŹŌŅŗ±äĄ¶É«µÄČÜŅŗÖŠ£ŗMg2+£¬Cl-£¬K+ | |
| D£® | Ź¹·ÓĢŖ±äŗģµÄČÜŅŗÖŠ£ŗNa+£¬Cl-£¬SO${\;}_{4}^{2-}$ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
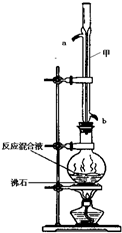 ±½¼×Ėį¼×õ„ŹĒŅ»ÖÖÖŲŅŖµÄ¹¤ŅµŌĮĻ£¬Ä³»ÆѧŠ”×é²ÉÓĆČēĶ¼×°ÖĆ£¬ŅŌ±½¼×Ėį”¢¼×“¼ĪŖŌĮĻÖĘČ”±½¼×Ėį¼×õ„£®ÓŠ¹ŲĪļÖŹµÄĪļĄķŠŌÖŹ¼ūĻĀ±ķĖłŹ¾£ŗ
±½¼×Ėį¼×õ„ŹĒŅ»ÖÖÖŲŅŖµÄ¹¤ŅµŌĮĻ£¬Ä³»ÆѧŠ”×é²ÉÓĆČēĶ¼×°ÖĆ£¬ŅŌ±½¼×Ėį”¢¼×“¼ĪŖŌĮĻÖĘČ”±½¼×Ėį¼×õ„£®ÓŠ¹ŲĪļÖŹµÄĪļĄķŠŌÖŹ¼ūĻĀ±ķĖłŹ¾£ŗ| ±½¼×Ėį | ¼×“¼ | ±½¼×Ėį¼×õ„ | |
| ČŪµć/”ę | 122.4 | -97 | -12.3 |
| ·Šµć/”ę | 249 | 64.3 | 199.6 |
| ĆܶČ/g£®cm-3 | 1.2659 | 0.792 | 1.0888 |
| Ė®ČÜŠŌ | Ī¢ČÜ | »„ČÜ | ²»ČÜ |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| t1”«t2 | t3”«t4 | t4”«t5 | t6”«t7 |
| K1 | K2 | K3 | K4 |

| ĪļÖŹ | CO2 | CH4 | CO | H2 |
| ÅØ¶Č£Ømol•L-1£© | 1 | 1 | 1 | 1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ČõĖį»ÆѧŹ½ | H2SO3 | H2CO3 |
| µēĄė³£Źż£Ø25”ę£© | Ka1=1.3”Į10-2 Ka2=6.3”Į10-8 | Ka1=4.2”Į10-7 Ka2=5.6”Į10-11 |
| A£® | c£ØHCO3-£©£¼c£ØCO32-£© | |
| B£® | Į½ČÜŅŗ¶¼ÄÜŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ« | |
| C£® | c£ØHCO3-£©£¾c£ØHSO3-£© | |
| D£® | c£ØCO32-£©+c£ØHCO3-£©=c£ØSO32-£©+c£ØHSO3-£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | H2 | B£® | CO2 | C£® | N2 | D£® | NH3 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com