
氮是大气中含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用,减少氮氧化物的排放是环境保护的重要内容之一.请回答下列氮及其化合物的相关问题:
(1)据报道,意大利科学家获得了极具研究价值的N4,其分子结构与白磷分子的正四面体结构相似.已知断裂1mol N﹣N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量,请写出N4气体转变为N2反应的热化学方程式: N4(g)=2N2(g);△H=﹣882kJ/mol .
(2)据报道,NH3可直接用作车用燃料电池,写出该电池的负极反应式: 2NH3+6OH﹣﹣6e﹣=N2+6H2O .
(3)在T1℃时,将5mol N2O5置于10L固定容积的密闭容器中发生下列反应:2N2O5(g)⇌4NO2(g)+O2(g);△H>0.反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%.
①求该反应的平衡常数K= 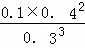 (数字代入式子即可),上述平衡体系中O2的体积分数为 12.5% .
(数字代入式子即可),上述平衡体系中O2的体积分数为 12.5% .
②用O2表示从0~5min内该反应的平均速率υ(O2)= 0.02mol/(L•min) .
③将上述平衡体系的温度降至T2℃,密闭容器内减小的物理量有 AC .
A.压强 B.密度 C.反应速率 D.N2O5的浓度
(4)在恒温恒容的密闭容器中充入NO2,建立如下平衡:2NO2(g)⇌N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是 B .
A.都引起a减小
B.都引起a增大
C.充入NO2引起a减小,充入N2O4引起a增大
D.充入NO2引起a增大,充入N2O4引起a减小.
| 化学平衡的影响因素;热化学方程式;电极反应和电池反应方程式.. | |
| 分析: | (1)N4气体转变为N2气体先破坏N4分子N﹣N键吸收能量,再生成N2分子形成N≡N键放出能量,注意一个N4分子中含有6个N﹣N键,根据能量的变化写出热化学反应方程式; (2)原电池中,负极上失去电子发生氧化反应,注意结合电解质溶液的酸碱性写电极反应式; (3)根据三段式计算出各组分的物质的量的变化量、平衡时各组分的物质的量; ①平衡常数指生成物浓度的系数次幂之积与反应物浓度系数次幂之积的比值,即k= ②根据v= ③该反应为吸热反应,降低温度平衡向逆反应进行,再根据选项具体分析; (4)平衡后分别再充入NO2和再充入N2O4,相当于增大体系压强,二氧化氮平衡转化率增大,平衡时N2O4与NO2的物质的量之比为a增大; |
| 解答: | 解:(1)根据原子守恒知,一个N4分子生成2个N2分子,一个N4分子中含有6个N﹣N键,破坏1molN4分子中含有6molN﹣N键需要吸收167kJ/mol×6mol=1002kJ能量; 生成2molN≡N键放出942kJ/mol×2mol=1884kJ能量,所以该反应放出1884kJ﹣1002kJ=882kJ能量,所以热化学反应方程式为N4(g)=2N2(g)△H=﹣882kJ/mol, 故答案为:N4(g)=2N2(g)△H=﹣882kJ/mol; (2)原电池中,负极上失去电子发生氧化反应,该反应中氨气发生氧化反应,所以负极上发生的反应是:氨气失电子和氢氧根离子反应生成氮气和水,电极反应式为 2NH3+6OH﹣﹣6e﹣=N2+6H2O,故答案为:2NH3+6OH﹣﹣6e﹣=N2+6H2O; (3)令平衡时O2的物质的量为nmol,则 对于反应 2N2O5(g)⇌4NO2(g)+O2(g), 开始(mol):5 0 0 变化(mol):2n 4n n 平衡(mol):5﹣2n 4n n 所以 ①由上述计算知平衡时N2O53mol、NO24mol、O21mol.所以平衡时N2O5的浓度为 所以平衡常数k= 平衡时O2的物质的量为NO2的 所以O2的体积分数为 故答案为: ②由上述计算知平衡时O2的质的量为1mol, 从0~5min内用O2表示该反应的平均速率v(O2)= 故答案为:0.02mol/(L•min); ③A.该反应正反应为吸热反应,降低温度平衡向逆反应进行,由于反应前气体体积比反应后小,所以压强减小,故A正确; B.都为气体,总质量不变,体积不变,所以密度不变,故B错误; C.温度降低,反应速率降低,故C正确; D.该反应正反应为吸热反应,降低温度平衡向逆反应进行,N2O5的浓度增加,故D错误. 故选:AC; (4)在恒温恒容的密闭容器中充入NO2,建立如下平衡:2NO2(g)⇌N2O4(g),平衡后分别再充入NO2和再充入N2O4,相当于增大体系压强,二氧化氮平衡转化率增大,平衡时N2O4与NO2的物质的量之比为a增大; 故答案为:B. |
| 点评: | 本题考查了反应热、原电池电极反应、平衡常数反应速率的影响因素分析判断,化学平衡移动、化学平衡常数及计算等,难度中等,考查学生分析和解决问题的能力和对知识的掌握. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是 ( )
A.硫酸铝溶液中加入过量氨水:Al3++3OH-===Al(OH)3 ↓
B.碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO===CaCO3↓+2OH-
C.冷的氢氧化钠溶液中通入氯气:Cl2+2OH-===ClO-+Cl-+ H2O
D.稀硫酸中加入铁粉:2Fe+6H+===2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列曲线图(纵坐标为沉淀的量,横坐标为加入物的量)与对应选项不正确的是( )
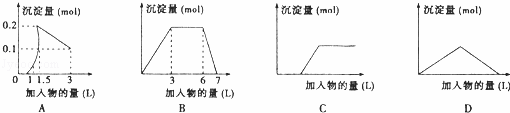
|
| A. | 向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液中加入0.1 mol/L稀H2SO4溶液 |
|
| B. | 向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的1L混合液中加入0.1mol/L NaOH溶液 |
|
| C. | 向烧碱溶液中滴加明矾溶液 |
|
| D. | 向Ca(OH)2溶液中逐渐通入二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
小明做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4﹣+H2C2O4+H+→CO2↑+Mn2++□(未配平).关于此反应的叙述正确的是( )
|
| A. | 该反应的氧化剂是H2C2O4 | B. | 1molMnO4﹣在反应中失去5mol电子 |
|
| C. | 该反应右框内的产物是OH﹣ | D. | 配平该反应后,H+的计量数是6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或结论表述正确的是( )
|
| A. | 纸层析实验中若选择水做固定相,有机溶剂做流动相,则亲水性强的成分在流动相中分配的少一些,在毛细现象作用下,随流动相移动的速度快一些 |
|
| B. | 判断CuO和MnO2对H2O2分解的催化效率,可通过比较H2O2溶液析出气泡的快慢程度,或测定单位时间内产生氧气的体积 |
|
| C. | 食醋总酸含量测定实验中,实验结束时碱式滴定管尖嘴部位有气泡,则测定的醋酸含量偏高 |
|
| D. | 将硫酸亚铁和硫酸铵的混合溶液加热浓缩,冷却结晶后可析出摩尔盐粗产品,再用酒精洗去晶体表面的水分,加热烘干后称重,计算产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
写出下列典型物质的电离方程式
(1)H2SO4________________________________________________________________;
(2)H2CO3________________________________________________________________;
(3)NaHSO4______________________________________________________________;
(4)NaHCO3______________________________________________________________;
(5)NaHSO4(熔融)________________________________________________________;
(6)Al2O3(熔融)__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
A.Fe2++SO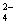 +Ba2++2OH-=BaSO4↓+Fe(OH)2↓
+Ba2++2OH-=BaSO4↓+Fe(OH)2↓
B.NH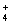 +Fe3++ 2SO
+Fe3++ 2SO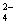 + 2Ba2+
+ 2Ba2+ + 4OH-=2BaSO4↓+ Fe(OH)3↓+ NH3·H2O
+ 4OH-=2BaSO4↓+ Fe(OH)3↓+ NH3·H2O
C.2Fe3++ 3SO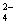 + 3Ba2++6OH-=3BaSO4↓+ 2Fe(OH)3↓
+ 3Ba2++6OH-=3BaSO4↓+ 2Fe(OH)3↓
D.3NH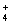 + Fe3++3SO
+ Fe3++3SO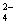 + 3Ba2++ 6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
+ 3Ba2++ 6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学称取一定质量的MgCl2固 体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
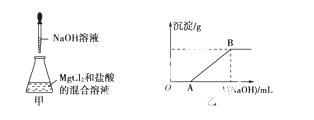
请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有________(填字母)。
a.天平 b.烧杯 c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为________________________________________________________________________。
(3)AB段反应的离子方程式为________________________________________________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是________,反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用高铁酸钠(Na2FeO4)对水消毒是城市饮用水处理的新技术。已知反应:Fe2O3+3Na2O2===2Na2FeO4+Na2O,下列说法正确的是 ( )
A.Na2O2既是氧化剂又是还原剂
B.Na2FeO4既是氧化产物又是还原产物
C.3 mol Na2O2发生反应,有12 mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com