
【题目】一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3)是常用的饮用水二级消毒剂。
(1)用Cl2和NH3反应制备三氯胺的方程式为3Cl2(g)+NH3(g)NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t /min | 0 | 40 | 80 | 120 | 160 |
甲(400℃)n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T℃)n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃_____400℃(填“>”或“<”),该反应的ΔH____0(填“>”或“<”)。
②该反应自发进行的条件是__________(填高温、低温、任何温度)。
③对该反应,下列说法正确的是_________(填选项字母)。
A. 若容器内气体密度不变,则表明反应达到平衡状态
B. 若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C. 反应达平衡后,其他条件不变,加入一定量的NCl3,平衡将向逆反应方向移动
D. 反应达到平衡后,其他条件不变,在原容器中按![]() 继续充入一定量反应物,达新平衡后Cl2的转化率增大
继续充入一定量反应物,达新平衡后Cl2的转化率增大
(2)工业上可利用反应2Cl2(g)+NH3(g)NHCl2(l)+2HCl(g)制备二氯胺。
①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出该反应的化学方程式______________________________。
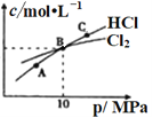
②在恒温条件下,将2molCl2和1molNH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是________点(填“A”“B”或“C”);B点时反应物转化率:α(Cl2)____α(NH3)(填“>”“=”或“<”),若B点平衡体积为2L,则平衡常数K=_____________。
【答案】> < 低温 AD NHCl2 +2H2O = 2HClO + NH3 C = 4
【解析】
(1)①根据温度对反应速率以及平衡移动的影响进行分析;
②ΔH-TΔS<0,反应能自发进行;
③A. NCl3(l)为液体,反应前后气体质量变化,气体体积不变,则气体的密度会随反应进行而变化;
B. 容器内Cl2和NH3物质的量之比为3:1,不能证明浓度不变;
C. 改变纯液体物质的用量,不影响平衡的移动;
D. 起始量为2molCl2和2molNH3,反应达到平衡后,其他条件不变,在原容器中按![]() 继续充入一定量反应物,相当于增大压强;
继续充入一定量反应物,相当于增大压强;
(2)①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质为次氯酸,另一物质为氨气;
②根据压强对平衡移动的影响比较转化率的大小;由于Cl2和NH3是按照化学计量数之比充入,则任一点均有,转化率:α(Cl2)=α(NH3);根据B点氯气和氯化氢物质的量相同,设参加反应氨气物质的量xmol,列三段式计算平衡时刻各气体物质的浓度,进而计算平衡常数。
(1)①温度越高,反应速率越快,其他条件相同时,由表格数据可知40min时,T℃时消耗氯气较多,且T℃时反应先达到平衡,则T℃时的反应速率比400℃时的反应速率快,则T℃>400℃;在400℃时,甲容器平衡后氯气为0.80mol,在T℃时,乙容器平衡后氯气为1.00mol,乙中剩余氯气较多,说明温度升高平衡逆向移动,则逆向为吸热反应,正向为放热反应,△H<0;故答案为:>;<;
②该反应正向为放热反应,且正向为熵减小的反应,ΔH-TΔS<0,反应能自发进行,则应为低温条件;故答案为:低温;
③A. NCl3(l)为液体,反应前后气体质量变化,气体体积不变,则气体的密度会随反应进行而变化,则若容器内气体密度不变,则表明反应达到平衡状态,故A正确;
B. 容器内Cl2和NH3物质的量之比为3:1,不能证明浓度不变,则不能表明反应达到平衡状态,故B错误;
C. NCl3为纯液体,改变其用量,不影响平衡的移动,故D错误;
D. 起始量为2molCl2和2molNH3,反应达到平衡后,其他条件不变,在原容器中按![]() 继续充入一定量反应物,相当于增大压强,平衡正向移动,达新平衡后Cl2的转化率增大,D项正确;故答案为:AD;
继续充入一定量反应物,相当于增大压强,平衡正向移动,达新平衡后Cl2的转化率增大,D项正确;故答案为:AD;
(2)①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质为次氯酸,该反应的化学方程式为NHCl2 +2H2O = 2HClO + NH3;故答案为:NHCl2 +2H2O = 2HClO + NH3;
②该反应2Cl2(g)+NH3(g)NHCl2(l)+2HCl(g)为气体体积减小的反应,增大压强平衡正向移动,氯气转化率增大,则A、B、C三点中氯气转化率最高的是C点;由于Cl2和NH3是按照化学计量数之比充入,则任一点均有,转化率:α(Cl2)=α(NH3);B点氯气和氯化氢物质的量相同,设参加反应氨气物质的量xmol,则可得三段式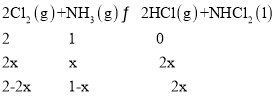 ,则2-2x=2x,解得x=0.5,则平衡是c(Cl2)=0.5mol/L,c(NH3)=0.25mol/L,c(HCl)=0.5mol/L,平衡常数
,则2-2x=2x,解得x=0.5,则平衡是c(Cl2)=0.5mol/L,c(NH3)=0.25mol/L,c(HCl)=0.5mol/L,平衡常数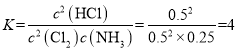 ;故答案为:C;=;4。
;故答案为:C;=;4。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】为了测定某铜银合金的成分,将![]() 合金完全溶解于
合金完全溶解于![]() 的浓硝酸中,收集到
的浓硝酸中,收集到![]() 标准状况
标准状况![]() 的气体
的气体![]() 反应生成气体只有NO和
反应生成气体只有NO和![]() ,并测得溶液中
,并测得溶液中![]() ,假设反应前后溶液的体积不变,则气体中NO、
,假设反应前后溶液的体积不变,则气体中NO、![]() 的体积比为
的体积比为
A.1:1B.2:1C.3:1D.1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我省盛产矿盐(主要成分是NaCl,还好有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
A. 有矿盐生成食盐,除去SO42-最合适的实际是Ba(NO3)2
B. 工业上通过电解氯化钠溶液制备金属钠和氯气
C. 室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D. 用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F的原子序数依次增大。A元素的基态阴离子的电子排布式与基态锂离子的相同,A和E位于同主族,基态B原子核外有3个能级且各能级上容纳的电子数相等,基态D原子核外有2个未成对电子,最外能层符号为L。+1价F离子的3d能级达到全充满结构。
回答下列问题:
(1)基态C原子价电子排布图为_________。
(2)B、C、D三种元素第一电离能由大到小排序为____(填元素符号,下同),它们的电负性由小到大排序为____。
(3)标准状况下,a L C2气体含π键的物质的量为__。与C2D互为等电子体的分子有___(任写一种)。B、C分别与D构成的阴离子中,立体构型为平面三角形的有___(填离子符号)。
(4)由A、B、C、D中的几种原子构成的分子中,含极性键的非极性分子有___(填一种,下同);既含极性键,又含非极性键的极性分子有___。
(5)C、F组成的晶体的晶胞如图所示。已知该晶体密度为ρ g·cm-3,NA代表阿伏加德罗常数的值,则C、F最近的核间距为____ pm。
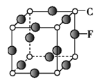
(6)A和E组成晶体,其晶胞如图所示。E粒子周围有___个E紧密相邻且最近;连接与E粒子等距离且最近的A粒子构成的形状是_____。
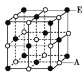
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101kPa时,2gC2H2(g)完全燃烧生成液态水时放出的热量是100kJ,则C2H2燃烧的热化学方程式是_________________________ 。
(2)已知:C(石墨,s)+O2(g) = CO2(g) △H = —393.5kJ·mol—1,C(金刚石,s)+ O2(g) =CO2(g) △H =—395.0kJ·mol—1,则反应C(石墨,s) = C(金刚石,s) △H =______kJ·mol—1。由此可知,石墨和金刚石相比更稳定的是 _______(填“石墨”或“金刚石”)。
(3)已知H2(g)的燃烧热△H 1=—285.0kJ·mol—1,CO(g)的燃烧热△H 2=—283.0kJ·mol—1, CH3OH(l)的燃烧热△H3=—726.0kJ·mol—1。0.2mol由H2 和CO组成的混合气体在完全燃烧时放出56.8kJ的能量,则混合气体中H2 和CO的质量比为_________。工业上在催化剂的作用下,可用H2(g)和CO(g)合成CH3OH(l)。请写出由H2(g)和CO(g)合成CH3OH(l)的热化学方程式:_______________________。
(4)强酸和强碱的稀溶液的中和热可表示为 H+ (aq)+OH— (aq) = H2O(l) △H =—57.3kJ·mol—1。已知:CH3COOH(aq)+NaOH(aq) = CH3COONa(aq)+H2O(l) △H =—33.1kJ·mol—1。请写出醋酸溶液电离的热化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小
B.乙烯与溴水发生加成反应的产物为溴乙烷
C.1mol苯恰好与3mol氢气完全加成,说明一个苯分子中有三个碳碳双键
D.C7H16,主链上有5个碳原子的同分异构体共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知①H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
②CH4 (g)+![]() O2(g)=CO (g)+2H2O(g) ΔH=-564.3kJ·mol-1
O2(g)=CO (g)+2H2O(g) ΔH=-564.3kJ·mol-1
则CH4(g)与H2O(g)反应制取CO(g)和H2(g)的热化学方程式:___。
(2)根据键能数据计算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热 ΔH=___kJ·mol-1。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(3)氢气是合成氨反应的重要原料。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟合成氨的工业化生产:N2(g)+3H2(g)![]() 2NH3(g) △H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示。
2NH3(g) △H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示。

回答下列问题:
①平衡时,M点NH3的体积分数为10%,则N2的物质的量为___(保留两位有效数字)。
②X轴上a点的数值比b点__(填“大”或“小”);图中,Y轴表示__(填“温度”或“压强”),判断的理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2。反应能够自发进行,则反应的ΔH___0(填“>”“<”或“=”)。
2CO2+N2。反应能够自发进行,则反应的ΔH___0(填“>”“<”或“=”)。
(2)已知:反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
根据表中数据,计算反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的K。
CO(g)+H2O(g)的K。
①平衡常数的表达式K1=___;
②温度为973K时:K=___;(结果保留小数点后2位)
③反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
(3)已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应___(填“已经”或“没有”)达到平衡,原因是__;此时刻v正__(填“>”或“<”)v逆。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应___(填“已经”或“没有”)达到平衡,原因是__;此时刻v正__(填“>”或“<”)v逆。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一。已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)![]() 2NO(g) ΔH1=akJ·mol-1
2NO(g) ΔH1=akJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g) ΔH2=bkJ·mol-1
2NO2(g) ΔH2=bkJ·mol-1
③CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH3=ckJ·mol-1
CO2(g) ΔH3=ckJ·mol-1
④2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH4
N2(g)+2CO2(g) ΔH4
请回答下列问题:
(1)根据反应①②③,确定反应④中ΔH4=____kJ·mol-1。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①的Kp=__(用表达式表示)。
(3)下列情况能说明反应②已达平衡状态的是__(填字母)。
A.单位时间内生成1molNO2的同时消耗了1molNO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,NO的体积分数保持不变
(4)试分析高温下不利于反应③自发进行的原因__。
(5)探究反应④中平衡时CO2的体积分数与反应物中起始![]() 的比值、温度的关系,得到如图2所示的曲线。在X、Y、Z三点中,CO的转化率从大到小的顺序是__。
的比值、温度的关系,得到如图2所示的曲线。在X、Y、Z三点中,CO的转化率从大到小的顺序是__。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com