
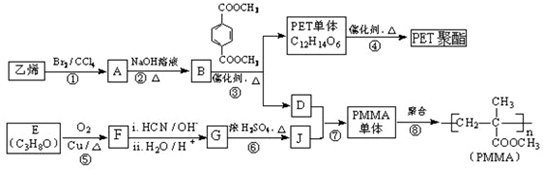
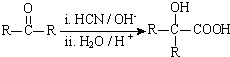 (R、R′代表烃基)
(R、R′代表烃基)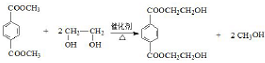 ;
; ;
;分析 由PMMA的结构,可知PMMA单体为CH2=C(CH3)COOCH3,则D、J分别为CH2=C(CH3)COOH、CH3OH中的一种,乙烯和溴发生加成反应生成A为CH2BrCH2Br,A在NaOH水溶液、加热条件下发生水解反应生成B为HOCH2CH2OH,根据信息I及PET单体分子式,可知PET单体为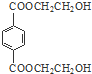 ,则D为CH3OH、J为CH2=C(CH3)COOH,PET单体发生信息I中交换反应进行的缩聚反应生成PET树脂为
,则D为CH3OH、J为CH2=C(CH3)COOH,PET单体发生信息I中交换反应进行的缩聚反应生成PET树脂为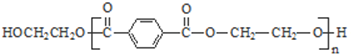 .F发生信息Ⅱ中的反应得到G,G在浓硫酸作用下发生消去反应生成J,则G为
.F发生信息Ⅱ中的反应得到G,G在浓硫酸作用下发生消去反应生成J,则G为 ,故F为
,故F为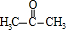 ,E为
,E为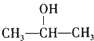 .
.
解答 解:由PMMA的结构,可知PMMA单体为CH2=C(CH3)COOCH3,则D、J分别为CH2=C(CH3)COOH、CH3OH中的一种,乙烯和溴发生加成反应生成A为CH2BrCH2Br,A在NaOH水溶液、加热条件下发生水解反应生成B为HOCH2CH2OH,根据信息I及PET单体分子式,可知PET单体为 ,则D为CH3OH、J为CH2=C(CH3)COOH,PET单体发生信息I中交换反应进行的缩聚反应生成PET树脂为
,则D为CH3OH、J为CH2=C(CH3)COOH,PET单体发生信息I中交换反应进行的缩聚反应生成PET树脂为 .F发生信息Ⅱ中的反应得到G,G在浓硫酸作用下发生消去反应生成J,则G为
.F发生信息Ⅱ中的反应得到G,G在浓硫酸作用下发生消去反应生成J,则G为 ,故F为
,故F为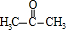 ,E为
,E为 .
.
(1)E为 .名称为2-丙醇,⑥的反应类型为消去反应,
.名称为2-丙醇,⑥的反应类型为消去反应,
故答案为:2-丙醇;消去反应;
(2)PMMA单体的结构简式为:CH2=C(CH3)COOCH3,
故答案为:CH2=C(CH3)COOCH3;
(3)反应③的化学方程式是: ,
,
故答案为: ;
;
(4)反应⑤的化学方程式: ,
,
故答案为: ;
;
(5)J为CH2=C(CH3)COOH,J的同分异构体符合下列条件:①能与NaOH溶液反应,说明含有羧基或酯基,②能使酸性高锰酸钾溶液的紫色褪去,说明含有碳碳双键,③分子中不含环状结构,
若属于羧酸,可以看作-COOH取代丙烯形成的酸,丙烯中有3种H原子,故酸有3种,若属于酯,有:CH2=CHCOOCH3,CH3COOCH=CH2,HCOOCH=CHCH3,HCOOCH2CH=CH2,HCOOC(CH3)=CH2,故符合条件的同分异构体共有8种,其中与J具有相同官能团,且核磁共振氢谱中4组峰,峰面积比为3:1:1:1的同分异构体的结构简式为CH3CH=CHCOOH,
故答案为:8;CH3CH=CHCOOH.
点评 本题考查有机物的推断与合成,充分利用给予的信息和有机物的结构进行推断,需要学生熟练掌握官能团的性质与转化,较好的考查学生自学能力、知识迁移运用,难度中等.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | O.lmol过氧化钠中,阴阳离子总数为0.4 NA | |
| B. | 11.2L氯气通入足量的NaOH充分反应,转移的电子数目为0.5 NA | |
| C. | 17g NH3气体含σ键的数目为3NA | |
| D. | 1L O.lmol/L氨水中,OH-数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
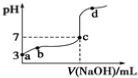
| A. | 由a点推知HA是弱酸 | B. | a、b点的溶液中,水的电离程度:a<b | ||
| C. | c点的溶液中:c(Na+)=c(A-)+c(HA) | D. | d点的溶液中:c(Na+)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
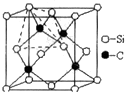 碳、氮、氟、硅、钛等元素的化合物广泛应用于生产生活,回答下列问题:
碳、氮、氟、硅、钛等元素的化合物广泛应用于生产生活,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.45 g | B. | 0.54 g | C. | 0.5 g | D. | 0.35 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
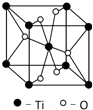 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 原子晶体 | 石墨 | 生石灰 | 碳化硅 | 金刚石 |
| 分子晶体 | 冰 | 固态氨 | 氯化铯 | 干冰 |
| 离子晶体 | 氮化铝 | 食盐 | 明矾 | 芒硝 |
| 金属晶体 | 铜 | 汞 | 铝 | 铁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com