
NaHCO3��Һ BaCl2Ũ�� | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | ���� | ���� | �������� |
| 0.1mol•L-1 | ���� | �������� | ������ |
| 0.02mol•L-1 | �������� | ������ | ������ |
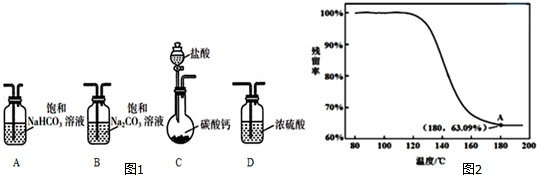
���� ��1��������̼��Ʒ�Ӧ���ɶ�����̼������Ȼ��ƣ����������ӷ����ݴ�ѡ��������
��2���ٱ��ͳ���ʯ��ˮ��̼���ƺ�̼�����ƾ��ܷ�Ӧ����̼��Ƴ������ݴ˽��
�ڣ�i�������ʱ��Һ�б�����Ũ����̼���Ũ�ȵij˻�����¶���̼�ᱵ���ܶȻ������Ƚϼ��ɣ�
��ii����������̼��������ӷ�Ӧ���ɶ�����̼��̼�ᱵ������
��ȡ��ʵ�����з���������Ʒ����pH�IJ���Ƚϼ��ɣ�
�ܷ���2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2������ͼ���������ݿ�֪��180��ʱ������IJ�����Ϊ63.09%�����ݷ���ʽ����100g������ȫ�ֽ�ʱʣ�������������ݴ˷�����
��� �⣺��1��CΪ����װ�ã�������̼��Ʒ�Ӧ���ɶ�����̼������Ȼ��ƣ����������ӷ�����Ӧ��ѡȡ̼�����Ƴ�ȥ��������е�HCl������������˳��Ϊ��CAB��
�ʴ�Ϊ��CAB��
��2���ٱ��ͳ���ʯ��ˮ��̼���ƺ�̼�����ƾ��ܷ�Ӧ����̼��Ƴ������ʼ��������У�
�ʴ�Ϊ�������У�
�ڣ�i��������Һ�������Ϻ���Һ�б�����Ũ��=$\frac{0.2mol/L}{2}$=0.1mol/L��0.1 mol•L-1 NaHC03��Һ�������c��CO32-��Ϊ0.0011 mol•L-1����Q=c��Ba2+����c��CO32-��=$\frac{0.2}{2}$��0.0011=1.1��10-4��5.1��10-9���ʻ����������
�ʴ�Ϊ��Qc=c��Ba2+����c��CO32-��=$\frac{0.2}{2}$��0.0011=1.1��10-4��5.1��10-9��
��ii����������̼�����Ƶ������̼����������̼�ᱵ�������Ӷ��ٽ���̼������ĵ��룬ʹ��������̼����������ӵķ����ƶ��������ӷ�Ӧ����ʽΪ��Ba2++2HCO3-=BaCO3��+CO2��+H2O��
�ʴ�Ϊ��Ba2++2HCO3-=BaCO3��+CO2��+H2O��
�۱�����Ϊ�ⶨpH��������̼����������ǿ�������Σ�����ˮ�����V mL����Һ������ȷ�Ƚϸߵ�pH�ƽ�����Ʒ��pHֵ��Ȼ�������������Ũ�ȵķ�����NaHC03��pHֵ�����Ƚϼ��ɣ�
�ʴ�Ϊ����ȡ�������ķ�����NaHC03����ˮ�����V mL����Һ����pH�Ʋ�pH��
�ܷ�����ӦΪ2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2������ͼ���������ݿ�֪��180��ʱ������IJ�����Ϊ63.09%��
��̼������Ϊ100g��
��2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2����
168 106
100g xg
���x=63.09g��
��������̼������ÿ��100g�ֽ�Ӧ����63.09g���壬
����ͼ��֪100g��Ʒ�ֽ�ǡ�����ɹ���Ϊ63.09g���ʴ���Ʒֻ����ΪNaHCO3��
�ʴ�Ϊ���ƵõĹ�����Ʒ�Ǵ�����NaHCO3��
���� ���⿼�������ʺ����IJⶨ��̼�����Ƶ����ʡ�Ksp���йؼ���ȣ���Ŀ�漰֪ʶ��϶࣬�ѶȽϴ���������̼�����Ƶ������Լ����ȷֽ�ԭ���ǽ������Ĺؼ���


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ����� | ʵ��Ŀ�� | |
| A | ��±�������뵽��NaOH��Һ��һ��ʱ���ȡ�ϲ�Һ�壬����AgNO3Һ�������� | ֤��±�����к���±Ԫ�� |
| B | ���ϩȩ��CH2=CH-CHO���м�����������������Һ����KMnO4��H+����Һ���۲���ɫ��ȥ | ֤���ṹ�д���̼̼˫�� |
| C | �����������������ˮ�⣬������������ͭ����Һ���뵽ˮ������Һ�� | �������ˮ��IJ��������� |
| D | ���еμӴ��ᣬ��������������ͨ�뱥��̼��������Һ��ͨ�뱽����Ũ��Һ | ֤�����ԣ����̼����� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ��ʵ�������Ʊ��������֤�������ʵ�װ��ͼ��
��ͼ��ʵ�������Ʊ��������֤�������ʵ�װ��ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| �������Ƽ���ѧʽ | �Ȼ���ͭCuCl | ��ʽ�Ȼ�ͭCu2��OH��3Cl |
| ���� | ��ɫ���塢����ˮ | ��ɫ���塢����ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����YΪ�������ʯī�缫���Y��ˮ��Һ�����ⷴӦΪ2HCl$\frac{\underline{\;���\;}}{\;}$H2��+C12����
����YΪ�������ʯī�缫���Y��ˮ��Һ�����ⷴӦΪ2HCl$\frac{\underline{\;���\;}}{\;}$H2��+C12�����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com