
【题目】某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序。请你原电池原理和实验装置,完成下列实验报告。
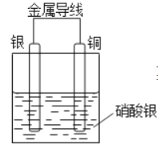
实验目的:探究Cu和Ag的金属活动性顺序
(1)电极材料:正极:_______________________ ;负极:_____________________________硝酸银溶液的作用是________________________________________________________
(2)写出电极反应式:
正极:_____________________________ ;负极:_____________________________ 。
(3)实验现象:________________________________________________________________。
(4)实验结论:________________________________________________________________。
【答案】银片 铜片 参与氧化还原反应和导电 正极:2Ag+ + 2e- =2Ag 负极:Cu–2e- =Cu2+ 负极不断溶解,正极上有银白色固体析出,溶液由无色变为蓝色 金属活动性Cu>Ag
【解析】
根据金属的活动性顺序判断,该原电池中,Cu为负极,Ag为正极,正极上发生的是得电子的还原反应,即Ag++e-=Ag,负极上发生的失电子的氧化反应,即Cu-2e-=Cu2+;Cu片不断溶解生成Cu2+,溶液从无色变为蓝色;溶液中的Ag+在正极上发生还原反应,有白色的银单质析出,可知,Cu可以将金属Ag从其盐中置换出来,所以金属的活动性顺序是Cu>Ag。
(1)该原电池中,Cu为负极,Ag为正极,电解质是硝酸银溶液,硝酸银溶液的作用是参与氧化还原反应和导电;
(2)在原电池的正极上发生的是得电子的还原反应,即Ag++e-=Ag,负极上发生的是电极本身失电子的氧化反应,即Cu-2e-=Cu2+;
(3)负极上发生氧化反应,Cu片不断溶解生成Cu2+,溶液从无色变为蓝色;溶液中的Ag+在正极上发生还原反应,有白色的银单质析出;
(4)根据原电池反应的现象,得出金属Cu可以将金属Ag从其盐中置换出来,所以金属的活动性顺序是Cu>Ag。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室制取少量干燥的氨气,所用下列装置、药品等正确的是
A.①是氨气发生装置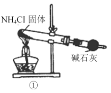 B.②是氨气发生装置
B.②是氨气发生装置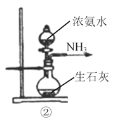
C.③是氨气收集、检验装置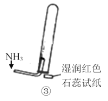 D.④是氨气吸收装置
D.④是氨气吸收装置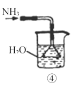
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如图所示:

有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -116 |
回答下列问题:
(1)写出该实验过程中发生的所有主要反应的化学方程式____;
在此制各实验中,要尽可能迅速地把反应温度170℃左右,其最主要目的是___(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入__,其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层,若产物中有少量未反应的Br2,最好用____洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(4)若产物中有少量副产物乙醚。可用____的方法除去,加热方式为____。
(5)反应过程中应用___冷却装置D
A.冰水混合物 B.室温下的水 C.60℃ D.100℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
B. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A,相对分子质量为140,其中碳的质量分数为0.857。A分子中有两个碳原子不与氢直接相连。A在一定条件下氧化只生成G,G能使石蕊试液变红。

试写出:
(1)A的分子式___________________。
(2)化合物A和G的结构简式: A___________________,G___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
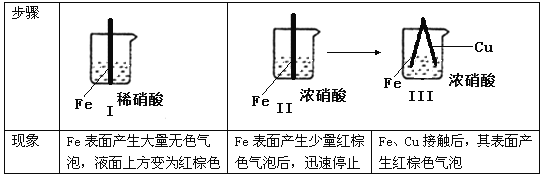
下列说法中不正确的是:
A. Ⅰ种气体有无色变红棕色的化学方程式为:2NO+O2=2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法处理酸性污水的工作原理如图所示,下列说法不正确是( )
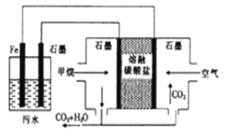
A. 铁电极的电极反应式为Fe-2e-=Fe2+
B. 通入甲烷的石墨的电极反应式为:CH4+4CO32-—8e- ==5CO2+2H2O
C. 为了增强的污水的导电能力,可向污水中加入适量食盐
D. 若左池石墨电极产生44.8L气体,则消耗0.5mol甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰干电池在放电时,电池的总反应方程式可以表示为: Zn+2MnO2 +2H2O = Zn(OH)2 +2MnOOH。电池放电时,负极上发生反应的物质是
A.Zn B.碳棒 C.MnO2 D.MnO2和H2O
【答案】A
【解析】
试题分析:根据总反应方程式可知Zn在反应中失去电子,发生氧化反应,所以作原电池的负极,MnO2得到电子,发生还原反应,作原电池的正极。因此答案是选项A。
考点:考查根据原电池反应原理确定电池的电极材料的知识
【题型】单选题
【结束】
17
【题目】在恒容隔热容器中,下列说法可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①1mol N≡N键断裂的同时,有6mol N-H键断裂
②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1
③保持其他条件不变时,体系气体密度不再改变
④NH3、N2、H2的体积分数都不再改变
⑤体系温度不再改变
A. ②③④ B. ①③⑤ C. ①④⑤ D. ③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com