
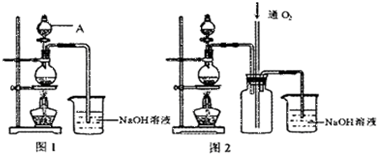
(6分)某研究性学习小组成员分别设计了如下甲、乙、丙三套实验装置制取乙酸乙酯。请回答下列问题: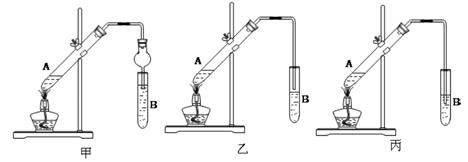
(1)A试管中的液态物质有___ ____。
(2)甲、乙、丙三套装置中,不宜选用的装置是___ ____。(选填“甲”、“乙’’、“丙’’)
(3)试管B中的液体能和生成物中混有的杂质发生反应,其化学方程式是______ _。
科目:高中化学 来源: 题型:阅读理解
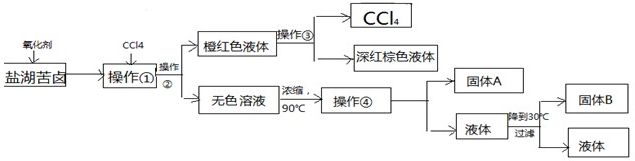
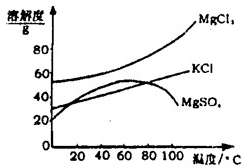 请根据以上流程,回答相关问题:
请根据以上流程,回答相关问题:| 化学式 | BaCO3 | BaSO4 | Ca SO4 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.9×10一4 | 3.5×10一5 | 1.6×10一11 |
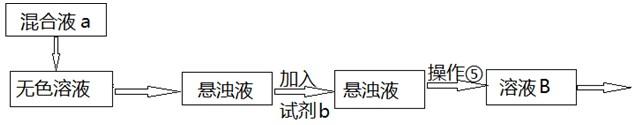
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
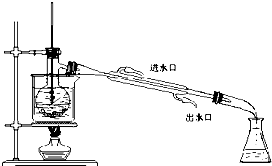
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的以碘离子形式存在的碘元素.海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的以碘离子形式存在的碘元素.海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: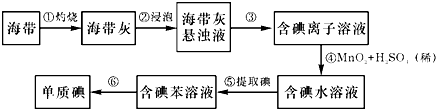
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
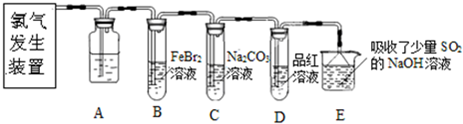
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 Ⅰ.铜与稀硝酸反应的离子方程式为
Ⅰ.铜与稀硝酸反应的离子方程式为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com