
| A、常温下,28g Fe与足量的浓硝酸反应,转移的电子数为1.5 NA |
| B、常温常压下,4.6 g的NO2和N2O4混合物中,含原子总数为0.3NA |
| C、1.0L 1.0 mol/LNaAlO2水溶液中含有的氧原子数为2NA |
| D、11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA |
| 4.6g |
| 46g/mol |


科目:高中化学 来源: 题型:
| A、在铁片上镀铜时,若阴极增重3.2g,则电镀液中通过的电子的物质的量为0.1mol |
| B、钢铁电化学腐蚀的两种类型主要区别在于水膜的PH不同,引起的负极反应不同 |
| C、参加反应的物质的性质是决定化学反应速率的重要因素 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极区产生的Cl2进入阳极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑤ | B、②③④⑥ |
| C、①②⑥ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在非标准状况下,1 mol O2的体积也有可能是22.4 L |
| B、在温度和压强一定时,气态物质的体积主要由气体分子数目和分子的大小决定 |
| C、同温同压下,0.3 mol N2和0.7 mol O2的体积比为3:7 |
| D、同温同压下,相同体积的任何气体所含有的分子数目一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.15 mol?L-1?min-1 |
| B、v(B)=0.015 mol?L-1?s-1 |
| C、v(C)=0.40 mol?L-1?min-1 |
| D、v(D)=0.45 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol乙基(-C2H5)中含有的电子数为17NA |
| B、标准状况下,22.4L氯仿(三氯甲烷)中共价键数目为4NA |
| C、1L pH=1的稀硫酸中有0.2 NA个H+ |
| D、78gNa2O2中含有2NA个阴离子(相对原子质量:Na-23 O-16) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠溶液中加入醋酸:CO32-+2H+=H2O+CO2↑ |
| B、稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑ |
| C、碳酸钙中加入盐酸:CO32-+2H+=H2O+CO2↑ |
| D、氢氧化钠溶液中加入硫酸:H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
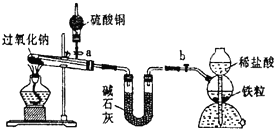 Na2O2是中学化学常用的强氧化剂,除了能与C02、H20反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.
Na2O2是中学化学常用的强氧化剂,除了能与C02、H20反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:
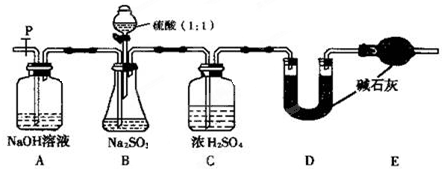
| 实验操作 | 现象和结论 |
| 步骤1:取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加H2SO4酸化的KMnO4溶液; | 现象:若KMnO4溶液的紫红色褪为无色 ①结论:样品中有 ②褪色的离子方程式为: |
| 步骤2:另取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加稀HCl,使溶液呈酸性,再滴加适量BaCl2溶液; | ③现象:若 结论:假设2成立. |
| … | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com