
【题目】下列说法中正确的是( )
A. ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子
B. 水很稳定是因为水中含有大量的氢键所致
C. H2O、NH3、CH4分子中的O、N、C分别形成2个、3个、4个键,故O、N、C原子分别采取sp、sp2、sp3杂化
D. 配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO42-
科目:高中化学 来源: 题型:
【题目】中国古代四大发明之一黑火药,它的爆炸反应为:S +2KNO3+3C ﹦ A+N2↑+3CO2↑(已配平)
(1)除S外,上述元素的电负性从小到大依次为_______。除K、S外第一电离能从大到小的顺序为______________。
(2)在生成物中,A为______化合物,CO2为_______化合物(填“离子化合物”或共价化合物),含极性共价键的分子的中心原子轨道杂化类型为______________。
(3)CN﹣与N2互为______,写出CN﹣的电子式________。推算HCN分子中σ键与π键数目之比_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A.碳酸氢铵溶液中加入足量的浓氢氧化钠溶液并加热:NH4++OH- =NH3↑+H2O
B.铜与稀硝酸的反应:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C.向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.过量二氧化硫与氢氧化钠溶液反应:SO2+OH- =HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用乙烯与甲苯为主要原料,按下列路线可合成有机物E、F:

已知:![]()
请回答:
(1)B中官能团的名称是_________,反应⑥的反应类型是__________。
(2)F的结构简式___________________________。
(3)D→E的化学方程式_________________________________。
(4)下列有关说法不正确的是_________。
A.E能与新制的Cu(OH)2悬浊液发生反应,而B不能与新制的Cu(OH)2悬浊液发生反应
B.![]() 不能使酸性KMnO4溶液褪色
不能使酸性KMnO4溶液褪色
C.1molE和足量H2反应,最多消耗4molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N![]() N放出942 kJ热量。根据以上信息和数据,判断下列说法正确的是( )
N放出942 kJ热量。根据以上信息和数据,判断下列说法正确的是( )

A. N4属于一种新型的化合物 B. N4分子中存在非极性键
C. N4和N2是同分异构体 D. 1 mol N4转变成N2将吸收882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列书写的离子方程式中,正确的是( )。
A. 酸性高锰酸钾溶液与乙二酸(草酸)反应:2MnO![]() +5C2O
+5C2O![]() +16H+===2Mn2++10CO2↑+8H2O
+16H+===2Mn2++10CO2↑+8H2O
B. 在NH4HSO4溶液中缓慢滴入含等物质的量的NaOH的溶液:NH![]() +OH-===NH3·H2O
+OH-===NH3·H2O
C. VO2+与酸性高锰酸钾溶液反应:5VO2++MnO![]() +H2O===5VO
+H2O===5VO![]() +Mn2++2H+
+Mn2++2H+
D. FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2===2Fe3++I2+4Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对如图所示的实验室制取氨气,下列说法正确的是
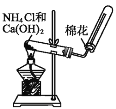
A.发生装置与用 KClO3 制取O2 的装置相同
B.可以用碱石灰或无水氯化钙干燥制得的氨气
C.可用单孔橡皮塞代替棉花
D.所用的铵盐不能是 NH4NO3,所用的碱可以是 NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。AC2是非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子在外界。根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为_________;
(2)B的氢化物的分子立体构型是_____;其中心原子采取_______杂化。
(3)写出化合物AC2的电子式为_______;一种由B、C组成的化合物与AC2互为等电子体,其化学式为______。
(4)E的核外电子排布式是______,ECl3形成的配合物的化学式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的单质及其化合物性质多样,用途广泛。
完成下列填空。
(1)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2;
2NO+2CO![]() 2CO2+N2+Q(Q>0)
2CO2+N2+Q(Q>0)
某温度下测得该反应在不同时间内的CO浓度如下表:
时间(s) 浓度(mol/L) | 0 | 1 | 2 | 3 | 4 | 5 |
c (CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
该反应的平衡常数表达式为________;温度升高,K值________(选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)=________;若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是_______________。
(2)工业合成氨的反应温度选择500℃左右的原因是_________________。
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是___________。
a.N2、H2、NH3的浓度之比为1∶3∶2
b.容器内的压强保持不变
c. N2、H2、NH3的浓度不再发生变化
d.反应停止,正、逆反应的速率都等于零
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度有大到小的顺序是____________;在通入NH3的过程中溶液的导电能力________(选填“变大”、“变小”、“几乎不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com