
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L SO3中含有的SO3分子数为0.1NA | |
| B. | 5.6 g Fe与标准状况下2.24L的Cl2充分反应,转移的电子数为0.3NA | |
| C. | 将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na+的浓度为2mol/L | |
| D. | 1molMnO2与4mol浓盐酸充分反应后生成的Cl2分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
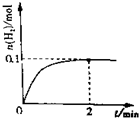 空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO2、NOx等进行研究具有重要意义.请回答下列问题:
空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO2、NOx等进行研究具有重要意义.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
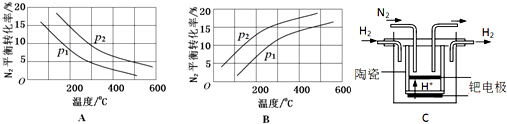
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 时间/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
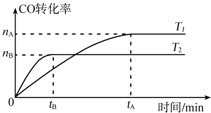 乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料.
乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com