
 FeO(s) +CO(g)µÄĘ½ŗā³£ŹżĪŖK1£»·“Ó¦¢ŚFe(s)+H2O(g)
FeO(s) +CO(g)µÄĘ½ŗā³£ŹżĪŖK1£»·“Ó¦¢ŚFe(s)+H2O(g) FeO(s)+H2(g)µÄĘ½ŗā³£ŹżĪŖK2”£ŌŚ²»Ķ¬ĪĀ¶ČŹ±K1”¢K2µÄÖµČēĻĀ±ķ
FeO(s)+H2(g)µÄĘ½ŗā³£ŹżĪŖK2”£ŌŚ²»Ķ¬ĪĀ¶ČŹ±K1”¢K2µÄÖµČēĻĀ±ķ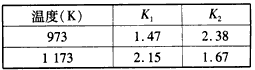
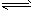 CO(g)+H2O(g)µÄĘ½ŗā³£ŹżKÓėK1”¢K2µÄ¹ŲĻµŹ½_________”£
CO(g)+H2O(g)µÄĘ½ŗā³£ŹżKÓėK1”¢K2µÄ¹ŲĻµŹ½_________”£ CO(g)+H2O(g)µÄ”÷H=__________”£
CO(g)+H2O(g)µÄ”÷H=__________”£ 
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
·“Ó¦¢Ł Fe(s)+CO2(g)===FeO(s)+CO(g)£»”÷H1= a kJmol-1
·“Ó¦¢Ś CO(g)+1/2O2(g)===CO2(g)£»”÷H2= b kJmol-1
²āµĆŌŚ²»Ķ¬ĪĀ¶ČĻĀ£¬ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠµÄ·“Ó¦¢ŁµÄĘ½ŗā³£ŹżKÖµĖęĪĀ¶ČµÄ±ä»ÆČēĻĀ£ŗ
![]()
£Ø1£©·“Ó¦¢ŁµÄ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½ĪŖ £¬a 0£ØĢī”°>”±”¢”°<”±»ņ”°=”±£©”£ ŌŚ 500”ę2L ĆܱÕČŻĘ÷ÖŠ½ųŠŠ·“Ó¦¢Ł£¬Fe ŗĶ CO2µÄĘšŹ¼ĪļÖŹµÄĮæ¾łĪŖ4mol£¬10minŗó“ļµ½Ę½ŗāדĢ¬£¬Ę½ŗāŹ±CO2µÄ×Ŗ»ÆĀŹĪŖ £¬ÓĆCO±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹĪŖ ”£
£Ø2£©700”ę·“Ó¦¢Łµ½Ę½ŗā£¬ŅŖŹ¹øĆĘ½ŗāĻņÓŅŅĘ¶Æ£¬ĘäĖüĢõ¼ž²»±äŹ±£¬æÉŅŌ²ÉČ”µÄ“ėŹ©ÓŠ £ØĢīŠņŗÅ£©”£
A£®ĖõŠ”·“Ó¦Ę÷Ģå»ż B£®ĶØČėCO2 C£®ÉżøßĪĀ¶Čµ½900”ę D£®Ź¹ÓĆŗĻŹŹµÄ“߻ƼĮ
£Ø3£©ĻĀĮŠĶ¼Ļń·ūŗĻ·“Ó¦¢ŁµÄŹĒ £ØĢīŠņŗÅ£©£ØĶ¼ÖŠvŹĒĖŁĀŹ”¢![]() ĪŖ»ģŗĻĪļÖŠCOµÄŗ¬Į棬TĪŖĪĀ¶Č£©”£
ĪŖ»ģŗĻĪļÖŠCOµÄŗ¬Į棬TĪŖĪĀ¶Č£©”£
£Ø4£©ÓÉ·“Ó¦¢ŁŗĶ¢ŚæÉĒóµĆ·“Ó¦2Fe(s)+O2(g)===2FeO(s) ”÷H3ÖŠµÄ”÷H3= £ØÓĆŗ¬a”¢bµÄ“śŹżŹ½±ķŹ¾£©”£
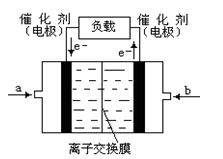
£Ø5£©ČēĻĀĶ¼ŹĒ¼×“¼Č¼ĮĻµē³Ų£Øµē½āÖŹČÜŅŗĪŖKOHČÜŅŗ£©µÄ½įŹ¾ŅāĶ¼£¬Ōņa“¦ĶØČėµÄŹĒ
£ØĢī”°¼×“¼”±»ņ”°ŃõĘų”±£©£¬b“¦µē¼«ÉĻ·¢ÉśµÄµē¼«·“Ó¦ŹĒ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
£Ø10·Ö£©£Ø1£©·“Ó¦Fe(s)+CO2(g)FeO(s)+CO(g) ”÷H1£¬Ę½ŗā³£ŹżĪŖK1
·“Ó¦Fe(s)+H2O(g)FeO(s)+H2(g) ”÷H2£¬Ę½ŗā³£ŹżĪŖK2
ŌŚ²»Ķ¬ĪĀ¶ČŹ±K1”¢K2µÄÖµČēĻĀ±ķ£ŗ
|
| 700”ę | 900”ę |
| K1 | 1£®47 | 2£®15 |
| K2 | 2£®38 | 1£®67 |
¢Ł·“Ó¦ CO2(g) + H2(g)CO(g) + H2O(g) ”÷H £¬Ę½ŗā³£ŹżK£¬Ōņ”÷H= £ØÓĆ”÷H1ŗĶ”÷H2±ķŹ¾£©£¬K= £ØÓĆK1ŗĶK2±ķŹ¾£©£¬ĒŅÓÉÉĻŹö¼ĘĖćæÉÖŖ£¬·“Ó¦CO2(g)+ H2(g)
CO(g) + H2O(g)ŹĒ ·“Ó¦£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©”£
¢ŚÄÜÅŠ¶ĻCO2(g)+ H2(g)CO(g) + H2O(g)“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ £ØĢīŠņŗÅ£©”£
A£®ČŻĘ÷ÖŠŃ¹Ēæ²»±ä B£®»ģŗĻĘųĢåÖŠc(CO)²»±ä
C£®vÕż(H2)= vÄę(H2O) D£®c(CO)=c(CO2)
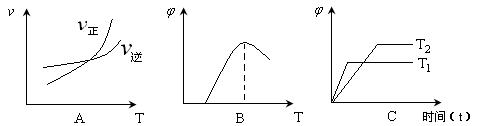
£Ø2£©Ņ»¶ØĪĀ¶ČĻĀ£¬ĻņijĆܱÕČŻĘ÷ÖŠ¼ÓČė×ćĮæĢś·Ū²¢³äČėŅ»¶ØĮæµÄCO2ĘųĢ壬·¢Éś·“Ó¦Fe(s)+CO2(g)FeO(s)+CO(g)”÷H > 0£¬CO2µÄÅضČÓėŹ±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ
¢ŁøĆĢõ¼žĻĀ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ £»ČōĢś·Ū×ćĮ棬CO2µÄĘšŹ¼ÅضČĪŖ2.0mol”¤L£1£¬ŌņĘ½ŗāŹ±CO2µÄÅØ¶Č mol”¤L£1”£
¢ŚĻĀĮŠ“ėŹ©ÖŠÄÜŹ¹Ę½ŗāŹ±Ōö“óµÄŹĒ £ØĢīŠņŗÅ£©
A£®ÉżøßĪĀ¶Č B£®Ōö“óŃ¹Ēæ
C£®³äČėŅ»¶ØĮæµÄCO2 D£®ŌŁ¼ÓČėŅ»¶ØĮæĢś·Ū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012½ģ¹ć¶«Ź”ČÄĘ½»ŖĒČ֊ѧøßČżµŚŅ»“ĪŌĀæ¼ĄķæĘ×ŪŗĻ»Æѧ²æ·ÖŹŌĢā ĢāŠĶ£ŗĢīæÕĢā
£Ø16·Ö£©ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠ£ŗ
·“Ó¦¢Ł Fe(s)+CO2(g) FeO(s)+CO(g) ”÷H1=" a" kJ”¤mol-1
FeO(s)+CO(g) ”÷H1=" a" kJ”¤mol-1
·“Ó¦¢Ś 2CO(g)+O2(g) 2CO2(g) ”÷H2=" b" kJ”¤mol-1
2CO2(g) ”÷H2=" b" kJ”¤mol-1
·“Ó¦¢Ū 2Fe(s)+O2(g) 2FeO(s) ”÷H3
2FeO(s) ”÷H3
£Ø1£©”÷H3= £ØÓĆŗ¬a”¢bµÄ“śŹżŹ½±ķŹ¾£©
£Ø2£©·“Ó¦¢ŁµÄ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½K= £¬ŅŃÖŖ500”ꏱ·“Ó¦¢ŁµÄĘ½ŗā³£ŹżK=1.0£¬ŌŚ“ĖĪĀ¶ČĻĀ2LĆܱÕČŻĘ÷ÖŠ½ųŠŠ·“Ó¦¢Ł£¬FeŗĶCO2µÄĘšŹ¼Įæ¾łĪŖ2.0mol£¬“ļµ½Ę½ŗāŹ±CO2µÄ×Ŗ»ÆĀŹĪŖ £¬COµÄĘ½ŗāÅضČĪŖ
£Ø3£©½«ÉĻŹöĘ½ŗāĢåĻµÉżĪĀÖĮ700”ę£¬ŌŁ“Ī“ļµ½Ę½ŗāŹ±ĢåĻµÖŠCOµÄÅØ¶ČŹĒCO2ÅØ¶ČµÄĮ½±¶£¬Ōņa 0£ØĢī”°>”±”¢”°<”±»ņ”°=”±£©”£ĪŖĮĖ¼Óæģ»Æѧ·“Ó¦ĖŁĀŹĒŅŹ¹ĢåĻµÖŠCOµÄĪļÖŹµÄĮæŌö¼Ó£¬ĘäĖüĢõ¼ž²»±äŹ±£¬æÉŅŌ²ÉČ”µÄ“ėŹ©ÓŠ £ØĢīŠņŗÅ£©”£
| A£®ĖõŠ”·“Ó¦Ę÷Ģå»ż | B£®ŌŁĶØČėCO2 |
| C£®ÉżøßĪĀ¶Č | D£®Ź¹ÓĆŗĻŹŹµÄ“߻ƼĮ |
 ĪŖ»ģŗĻĪļÖŠCOŗ¬Į棬TĪŖĪĀ¶Č£©”£
ĪŖ»ģŗĻĪļÖŠCOŗ¬Į棬TĪŖĪĀ¶Č£©”£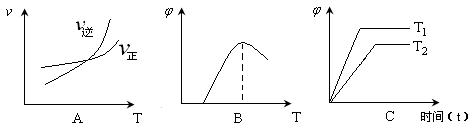
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2011-2012ѧğÕć½Ź”ŗ¼ÖŻµŚ¶žÖŠŃ§ø߶žĻĀŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø“ų½āĪö£© ĢāŠĶ£ŗĢīæÕĢā
£Ø10·Ö£©£Ø1£©·“Ó¦Fe(s)+CO2(g) FeO(s)+CO(g) ”÷H1£¬Ę½ŗā³£ŹżĪŖK1
FeO(s)+CO(g) ”÷H1£¬Ę½ŗā³£ŹżĪŖK1
·“Ó¦Fe(s)+H2O(g) FeO(s)+H2(g) ”÷H2£¬Ę½ŗā³£ŹżĪŖK2
FeO(s)+H2(g) ”÷H2£¬Ę½ŗā³£ŹżĪŖK2
ŌŚ²»Ķ¬ĪĀ¶ČŹ±K1”¢K2µÄÖµČēĻĀ±ķ£ŗ
| | 700”ę | 900”ę |
| K1 | 1£®47 | 2£®15 |
| K2 | 2£®38 | 1£®67 |
 CO(g) + H2O(g) ”÷H£¬Ę½ŗā³£ŹżK£¬Ōņ”÷H= £ØÓĆ”÷H1ŗĶ”÷H2±ķŹ¾£©£¬K= £ØÓĆK1ŗĶK2±ķŹ¾£©£¬ĒŅÓÉÉĻŹö¼ĘĖćæÉÖŖ£¬·“Ó¦CO2(g) + H2(g)
CO(g) + H2O(g) ”÷H£¬Ę½ŗā³£ŹżK£¬Ōņ”÷H= £ØÓĆ”÷H1ŗĶ”÷H2±ķŹ¾£©£¬K= £ØÓĆK1ŗĶK2±ķŹ¾£©£¬ĒŅÓÉÉĻŹö¼ĘĖćæÉÖŖ£¬·“Ó¦CO2(g) + H2(g) CO(g) + H2O(g)ŹĒ ·“Ó¦£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©”£
CO(g) + H2O(g)ŹĒ ·“Ó¦£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©”£ CO(g) + H2O(g)“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ £ØĢīŠņŗÅ£©”£
CO(g) + H2O(g)“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ £ØĢīŠņŗÅ£©”£ FeO(s)+CO(g) ”÷H > 0£¬CO2µÄÅضČÓėŹ±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ
FeO(s)+CO(g) ”÷H > 0£¬CO2µÄÅضČÓėŹ±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ
 Ōö“óµÄŹĒ £ØĢīŠņŗÅ£©
Ōö“óµÄŹĒ £ØĢīŠņŗÅ£©²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2011-2012ѧğŗŚĮś½Ź”øßČżµŚČż“ĪÄ£Äāæ¼ŹŌĄķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø14·Ö£©·“Ó¦¢Ł Fe(s)+CO2(g)===FeO(s)+CO(g)£»”÷H1= a kJmol-1·“Ó¦¢Ś CO(g)+1/2O2(g)===CO2(g)£»”÷H2= b kJmol-1²āµĆŌŚ²»Ķ¬ĪĀ¶ČĻĀ£¬ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠµÄ·“Ó¦¢ŁµÄĘ½ŗā³£ŹżKÖµĖęĪĀ¶ČµÄ±ä»ÆČēĻĀ£ŗ

(1)·“Ó¦¢ŁµÄ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½ĪŖ £¬a 0£ØĢī”°>”±”¢”°<”±»ņ”°=”±£©”£ ŌŚ 500”ę2L ĆܱÕČŻĘ÷ÖŠ½ųŠŠ·“Ó¦¢Ł£¬Fe ŗĶ CO2µÄĘšŹ¼ĪļÖŹµÄĮæ¾łĪŖ4mol£¬10minŗó“ļµ½Ę½ŗāדĢ¬£¬Ę½ŗāŹ±CO2µÄ×Ŗ»ÆĀŹĪŖ £¬ÓĆCO±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹĪŖ ”£
(2)700”ę·“Ó¦¢Łµ½Ę½ŗā£¬ŅŖŹ¹øĆĘ½ŗāĻņÓŅŅĘ¶Æ£¬ĘäĖüĢõ¼ž²»±äŹ±£¬æÉŅŌ²ÉČ”µÄ“ėŹ©ÓŠ__________£ØĢīŠņŗÅ£©”£
A£®ĖõŠ”·“ӦȯĘ÷Ģå»ż B£®ĶØČėCO2
C£®ÉżøßĪĀ¶Čµ½900”ę D£®Ź¹ÓĆŗĻŹŹµÄ“߻ƼĮ
(3)ÓÉ·“Ó¦¢ŁŗĶ¢ŚæÉĒóµĆ·“Ó¦ 2Fe(s)+O2(g)===2FeO(s) ”÷H3ÖŠµÄ”÷H3= £ØÓĆŗ¬a”¢bµÄ“śŹżŹ½±ķŹ¾£©”£
(4)ČēĶ¼ŹĒ¼×“¼Č¼ĮĻµē³Ų£Øµē½āÖŹČÜŅŗĪŖKOHČÜŅŗ£©µÄ½į¹¹Ź¾ŅāĶ¼£¬Ōņa“¦ĶØČėµÄŹĒ £ØĢī”°¼×“¼”±»ņ”°ŃõĘų”±£©£¬b“¦µē¼«ÉĻ·¢ÉśµÄµē¼«·“Ó¦Ź½£ŗ

²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com