
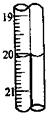
| A. | 20.00mL | B. | 20.0mL | C. | 20.10mL | D. | 20.1mL |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 化学性质 | 实际应用 | |
| A | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
| B | 铁比铜金属性强 | 刻制印刷电路板 |
| C | 次氯酸盐具有氧化性 | 作杀菌消毒剂 |
| D | 二氧化硫具有漂白性 | 漂白纸浆 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
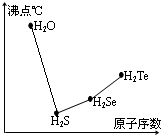 氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响.如氧气、水、臭氧、二氧化硫等.
氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响.如氧气、水、臭氧、二氧化硫等.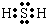 .在H2S分子中,两个H-S键之间的夹角小于(填“大于”、“小于”或“等于”)180°,H2S分子属极性极性此空不填(填“极[来源:]性”或“非极性”)分子.
.在H2S分子中,两个H-S键之间的夹角小于(填“大于”、“小于”或“等于”)180°,H2S分子属极性极性此空不填(填“极[来源:]性”或“非极性”)分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 埋在地下的钢管与电源负极连接可以减缓腐蚀 | |
| B. | 原电池负极和电解池阳极发生的都是氧化反应 | |
| C. | 钢铁析氢腐蚀的正极反应:2H++2e→H2↑ | |
| D. | 为了避免青铜器生成铜绿,将青铜器放在银质托盘上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
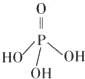 磷元素的单质及其化合物在生产和生活中有着广泛的应用.
磷元素的单质及其化合物在生产和生活中有着广泛的应用.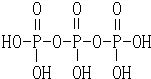 .
.| 电离常数(25℃) |
| HF:Ki=3.6×10 -4 |
| H3PO4:Ki1=7.5×10 -3, Ki2=6.2×10 -8,Ki3=2.2×10 -13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中Fe2O3是还原剂 | |
| B. | Fe2O3可以通过铁丝在氧气中燃烧制得 | |
| C. | 3molNa2O2反应,有3mol电子转移 | |
| D. | 在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
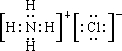 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com