
【题目】在洗衣粉配方中,应用最广的阴离子表面活性剂是( )
A.脂肪聚氧乙烯醚B.皂片
C.十二烷基苯磺酸钠D.脂肪醇硫酸钠
科目:高中化学 来源: 题型:
【题目】山梨酸是目前国际上公认的安全防腐剂。山梨酸可由山梨醛经如下过程合成:
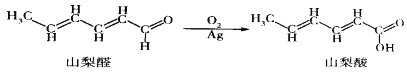
下列有关说法正确的是( )
A. 山梨酸与CH2=CH-COOH互为同系物
B. 山梨醛能发生取代、氧化、还原和加成反应
C. 与山梨酸含有相同官能团且含一个五元环的山梨酸的同分异构体有5种
D. 山梨酸分子中处于同一平面的原子最多13个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molSO2与2molO2的混合气体分别置于容积相等的甲、乙两容器中,发生反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0,在相同温度下使其均达到平衡状态。甲是恒压容器,乙是恒容容器。甲容器达到平衡状态时,测得混合气体的物质的量为4.2mol;乙容器经50s达到平衡状态.请回答:
2SO3(g);△H<0,在相同温度下使其均达到平衡状态。甲是恒压容器,乙是恒容容器。甲容器达到平衡状态时,测得混合气体的物质的量为4.2mol;乙容器经50s达到平衡状态.请回答:
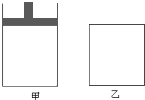
(1)甲容器达到平衡时SO2的转化率是_______,其所需时间___50s(填“>”、“<”或“=”)。
(2)达到平衡状态后,要使甲、乙两容器中SO2的物质的量相等,可采取的措施是___(填字母)。
A.保持温度不变,适当扩大甲容器的容积
B.保持容积不变,使乙容器升温
C.保持容积和温度不变,向乙容器中加入适量SO3(g)
D.保持容积和温度不变,向甲容器中加入适量SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物F具有抗肿瘤、降血糖、降血压等多种生物活性,其合成路线如下:

已知:M的结构简式为: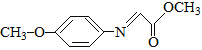 。
。
请回答下列问题:
(1)A的化学名称是_______________,B的化学式是________________。
(2)C中官能团的名称是__________________________。
(3)写出F的结构简式__________________________。
(4)已知A在一定条件下能生成可降解的聚酯,请写出该反应化学方程式:______________________________。
(5)满足下列条件的M的同分异构体有_______种(不含立体异构)。
① 能够发生银镜反应。
② 含有硝基(–NO2),且硝基直接连在苯环上。
③ 含有苯环且苯环上只有两个取代基。
其中核磁共振氢谱为四组峰且峰面积之比为6∶2∶2∶1的结构简式为________(写出一种即可)。
(6)写出用乙醛为原料制备高分子化合物聚丙烯腈的合成路线(无机试剂任选):______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是
序号 | 不纯物 | 除杂试剂 | 分离方法 |
A | C2H5OH(H2O) | Na | 蒸馏 |
B | CH4(C2H4) | 溴水 | 洗气 |
C | 苯(苯酚) | 浓溴水 | 过滤 |
D | 甲苯(苯) | 酸性高锰酸钾溶液 | 分液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 4种元素的原子序数均小于18,其最高正价依次为+1、+4、+5、+7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应水化物是已知无机含氧酸中最强的酸。则:
(1)A、B、C、D分别是______、______、________、________。
(2)A的离子结构示意图为__________,C的原子结构示意图为__________。
(3)C的最高价氧化物对应水化物与A的氢氧化物反应生成____种盐,其化学式分别为____、_____、_____(可不填满,也可补充)。
(4)C、D的气态氢化物稳定性由强到弱的顺序是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三蝶烯是最初的“分子马达”的关键组件,三碟烯某衍生物X可用于制备吸附材料,其结构如图所示,3个苯环在空间上互为120°夹角。下列有关X的说法错误的是

A. 分子式为C22H14O4
B. 能发生加成、取代反应
C. 苯环上的一氯代物有3种
D. 分子中最多可能有20个原子位于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
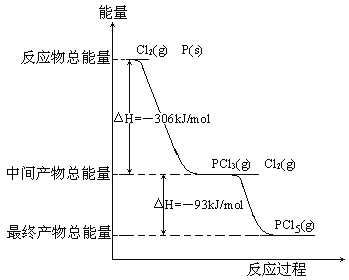
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式_________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式_________________________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于_________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2_______α1(填“大于”、“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是________________________________________。
(4)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A. 食醋除去瓶胆内的水垢:CaCO3+2H+===Ca2++CO2↑+H2O
B. 漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
C. Al溶于NaOH溶液:2Al+2OH-+2H2O===2 AlO+3H2↑
D. 用惰性电极电解硫酸铜溶液:2Cu2++4OH-![]() 2Cu+O2↑+2H2O
2Cu+O2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com