
在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一定正确的是( )
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.向氯水中滴加石蕊试液,溶液先变红后褪色,说明溶液中有盐酸和次氯酸。
C.加 入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明氯水中有Cl-存在
入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明氯水中有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:2016-2017学年湖北宜昌金东方中学、三峡高中高一11月月考化学卷(解析版) 题型:计算题
)现有Ba(OH)2与NaOH的混合溶液100 mL,c(OH-)=0. 1mol/L。向其中逐滴加入0.025 mol/L的 H2SO4溶液,当滴至沉淀不再增加时,所消耗的酸的体积是完全中和该混合溶液所耗酸体积的一半。请计算:【要求写出简要计算过程】
⑴原混合溶液中Ba(OH)2的物质的量浓度为 ;
⑵NaOH的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二12月月考化学卷(解析版) 题型:选择题
常温下,0.1 mol·L-1的某一元酸(HA)溶液中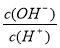 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中水电离出的c(H+)=1×10-11mol•L-1
C.该溶液中水的离子积常数为1×1022
D.用 pH=11的NaOH 溶液 V1 L 与V2 L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上期中化学试卷(解析版) 题型:选择题
下图是某同学用500 mL容量瓶配制0.10 mol·L-1Na2CO3溶液的步骤:
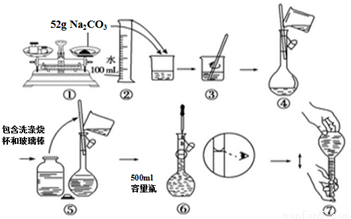
该同学的错误是
A. ①⑤⑥ B. ②④⑦ C. ①⑥ D. ⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上期中化学试卷(解析版) 题型:选择题
下列变化中,加入氧化剂可实现的是( )
A.I-→I2 B.Fe3+→Fe2+ C. FeO→Fe  D.HCl→AgCl
D.HCl→AgCl
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上期中化学试卷(解析版) 题型:选择题
下列判断合理的是
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
②蔗糖、硫酸钡和二氧化碳分别属于非电解质、电解质和酸性氧化物
③根据分散系是否具有丁达尔效应将分散系分为溶液、胶体和浊液
④根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
⑤根据Na2O、Na2O2组成元素相同,均与H2O反应,故均属于碱性氧化物
A.②⑤ B.②④ C.①②⑤ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上期中化学卷(解析版) 题型:选择题
在某温度时,将n mol·L-1氨水滴入10mL 1.0mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是:
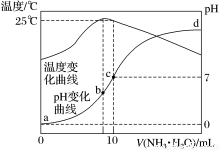
A.a点Kw=1.0×10-14
B.水的电离程度:c > b >a>d
C.b点:c(NH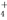 )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
D.25℃时,NH4Cl水解常数Kh= 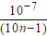 mol·L-1 (用含n的代数式表示)
mol·L-1 (用含n的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江佳木斯一中高一上月考二化学卷(解析版) 题型:实验题
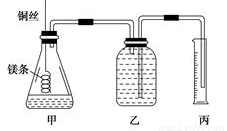
② 配制100mL.1.0mol·L-1的盐酸溶液;
②用__________(填仪器名称并注明规格)量取10.0mL 1.0mol·L-1的盐酸溶液加入锥形瓶甲中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为__________g;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题。
(1)步骤①中,配制100mL 1.0mol·L-1的盐酸溶液时,下列哪些操作会使配制浓度偏小________(填写字母)。
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
(2)请填写操作步骤中的空格:步骤②_________,步骤③_________g。
(3)实验步骤⑤中应选用____________(填字母)的量筒;
A.100mL B.200mL C.500mL
读数时除恢复到室温,调节乙丙内液面相平外,还要注意 。
(4)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm=____________L/mol。
(5)若未除去镁条表面的氧化镁,则测得该条件下气体的摩尔体积 (填偏大、偏小或无影响)。
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上学期12月月考化学试卷(解析版) 题型:填空题
环境问题已成为全球普遍的热门话题。
(1)氮氧化物是空气的主要污染源之一。可利用甲烷催化还原氮氧化物。已知:
CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g) ΔH1= -867 kJ·mol-1
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) ΔH2= -564 kJ·mol-1
则CH4将NO还原为N2的热化学方程式为 。
(2)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。催化反硝化法中,用H2在催化剂表面将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则反应的离子方程式为 。

(3)居室装修材料会挥发出甲醛,污染空气。通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的工作原理如图所示,其负极电极反应式为 。
(4)排放到大气中的SO2会形成硫酸型酸雨,SO2形成酸雨的化学方程式为 。燃煤火电发电厂的尾气中含SO2,常用Na2SO3溶液或氨水吸收尾气,生成NaHSO3 或NH4HSO3,已知NaHSO3溶液显酸性,则其溶液中离子浓度大小关系为 。
(5)已知25℃时,Ksp(BaSO4) =1.0 ×10-10mol2·L-2 。现将4.0×10-4mo1/L 的Na2SO4 溶液与一定浓度的BaCl2溶液等体积混合生成沉淀,计算应加入BaCl2溶液的最小浓度为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com