
工业尾气中的氮氧化物常用氨催化吸收法,原理是NH3和NOx反应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。
Ⅰ.提供的装置

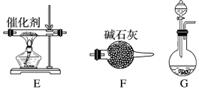
Ⅱ.NH3的制取
(1)下列有关实验室制备气体的说法正确的是________(填序号)。
①可以用排饱和食盐水的方法收集氯气 ②用赤热的炭与水蒸气反应制取氢气 ③实验室制氧气有时需要加热,有时不需要加热 ④用无水氯化钙干燥氨气 ⑤用浓盐酸洗涤高锰酸钾分解制氧气的试管
(2)从所提供的装置中选取一个能制取氨气的装置:__________________________(填字母)。
(3)当采用你所选用的装置制取氨气时,相应反应的化学方程式是________________________________________________________________________。
Ⅲ.模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:

(4)A中反应的离子方程式为_______________________________________________
________________________________________________________________________。
(5)装置D的作用有:使气体混合均匀、调节气流速度,还有一个作用是________________________________________________________________________。
(6)D装置中的液体可换成________(填字母)。
a.CuSO4 b.H2O c.CCl4 d.浓硫酸
(7)该同学所设计的模拟尾气处理实验还存在的明显缺陷是____________________________。
答案 (1)①③⑤
(2)C(或G)
(3)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O(或NH3·H2O+CaO===Ca(OH)2+NH3↑,对应即可)
2NH3↑+CaCl2+2H2O(或NH3·H2O+CaO===Ca(OH)2+NH3↑,对应即可)
(4)3Cu+2NO +8H+===3Cu2++2NO↑+4H2O
+8H+===3Cu2++2NO↑+4H2O
(5)防止NH3发生倒吸
(6)c
(7)NO尾气直接排放,没有进行处理
解析 (2)实验室制备氨气可用氢氧化钙与氯化铵固体加热法,也可以用浓氨水与氧化钙(或氢氧化钠)在常温下制取,故可选装置为C或G。(3)根据所选装置写出相应制备反应的化学方程式。(4)A中为Cu与稀硝酸的反应:3Cu+2NO +8H+===3Cu2++2NO↑+4H2O。(5)NH3是易溶于水的气体,因此D还可以防止倒吸。(6)D中用饱和氨水防止氨气被吸收,因此还可以换成CCl4。(7)该反应中尾气含有NO等污染性气体,应除去后再排入空气中。
+8H+===3Cu2++2NO↑+4H2O。(5)NH3是易溶于水的气体,因此D还可以防止倒吸。(6)D中用饱和氨水防止氨气被吸收,因此还可以换成CCl4。(7)该反应中尾气含有NO等污染性气体,应除去后再排入空气中。


科目:高中化学 来源: 题型:
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度来看,不恰当的一种物质是________。
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式________________________________________________________________________
________________________________________________________________________。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是________。
A.Ag B.Cu
C.Al D.Fe
(4)烧碱、纯碱溶液均可吸收CO2,当含0.1 mol NaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:①________;②Na2CO3;③________;④NaHCO3。
将得到的固体重新溶解于水,在溶液中加盐酸,使溶液的pH=7,再将溶液蒸干,得到固体的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子的外围电子排布式为 。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③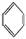 、④HCHO,其中碳原子采取sp2杂化的分子有
、④HCHO,其中碳原子采取sp2杂化的分子有
(填物质序号),HCHO分子的立体结构为 形。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 。

(5)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如右上图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产纯碱的工艺流程示意图如下:

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式:A________,B________。
(2)实验室提纯粗盐的实验操作依次为取样、________、沉淀、________、________、冷却结晶、________、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是_______________________
________________________________________________________________________。
碳酸化时没有析出碳酸钠晶体,其原因是__________________________________________
________________________________________________________________________。
(4)碳酸化后过滤,滤液D最主要的成分是______________________(填写化学式),检验这一成分的阴离子的具体方法是:_____________________________________________。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水时所发生的反应的离子方程式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2===2NO,经测定前3 s用N2表示的反应速率为0.1 mol·L-1·s-1,则6 s末NO的浓度为
A.1.2 mol·L-1 B.大于1.2 mol·L-1
C.小于1.2 mol·L-1 D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( )
| 选项 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为2 L的密闭容器中,有反应:mA(g)+nB(g)pC(g)+qD(g),经过5分钟达到平衡,此时各物质的变化为A减少a mol·L-1,B的平均反应速率v(B)= mol·L-1· min-1,C增加
mol·L-1· min-1,C增加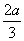 mol·L-1,这时若增加系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
mol·L-1,这时若增加系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
A.3∶1∶2∶2 B.1∶3∶2∶2
C.1∶3∶2∶1 D.1∶1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
运用电离常数判断可以发生的反应是( )
| 酸 | 电离常数(25 ℃) |
| 碳酸 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| 次溴酸 | Ki=2.4×10-9 |
①HBrO+Na2CO3===NaBrO+NaHCO3
②2HBrO+Na2CO3===2NaBrO+H2O+CO2↑
③HBrO+NaHCO3===NaBrO+H2O+CO2↑
④NaBrO+CO2+H2O===NaHCO3+HBrO
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com