
根据相关的化学原理,下列判断正确的是 ( )
A.由于水中存在氢键,所以稳定性:H2O>H2S
B.由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2 C.若A2 + 2D— == 2A— + D2,则氧化性D2>A2
D.若R2—和M+的电子层结构相同,则离子半径R2—>M+
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
由A、B两容器(如图所示),A容器固定,B容器可变。一定温度下,在A中加2 mol N2、3 mol H2发生反应:N2(g)+3H2(g)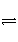
 2NH3(g),达到平衡时生成NH3的物质的量为n。
2NH3(g),达到平衡时生成NH3的物质的量为n。
(1)相同温度下,在B中充入4 mol N2、6 mol H2,当B的压强与A的压强相等,B中反应达到平衡时,生成NH3的物质的量________2n(填“>”、“<”或“=”);当B的体积与A的体积相等,B中反应达到平衡时,生成NH3的物质的量______2n(填“>”、“<”或“=”)。
(2)相同温度下,保持B的容积为A的一半,并加入1 mol NH3,要使B中反应达到平衡时各物质的量分别与上述A容器中平衡时相同,则起始时应加入______mol N2和______mol H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,设计正确且能达到实验目的的是( )
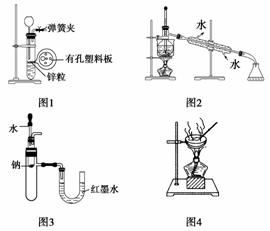
A.用图1所示装置制取少量H2
B.用图2所示装置分离Na2CO3溶液和CH3COOC2H5的混合物
C.用图3所示装置验证Na和水反应的热效应
D.用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法中正确的是 ( )
A.第一电离能越大的原子越容易得到电子 B.同周期元素从左到右第一电离能一定增大
C.同周期元素电负性从左到右越来越大 D.金属元素的电负性一定小于非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子或离子中,中心原子价层电子对互斥模型为四面体型,且分子或离子空间构型为V形的是( )
A.NH4+ B.ClO3- C.H3O+ D.H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是( )
A.该晶体属于原子晶体,其化学键比金刚石中的碳碳键更牢固
B.该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子
C.该晶体中碳原子和氮原子的最外层都满足8电子结构
D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
水的电离平衡曲线如下图所示。
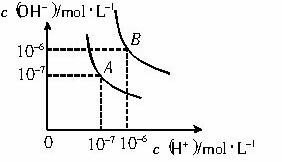
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,Ca(OH)2的离子积为 。
(4))25℃时,在等体积的 ① pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是 。
(5)等体积的下列溶液中,阴离子的总物质的量最大的是_________(填序号)。
① 0.1 mol·L-1的CuSO4溶液 ② 0.1 mol·L-1的Na2CO3
③ 0.1 mol·L-1的KCl ④ 0.1 mol·L-1的NaHCO3
(6)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A = H+ + HA- , HA- H+ + A2- 。
H+ + A2- 。
①则Na2A溶液显________(填“酸性”“中性”或“碱性”);NaHA溶液显________(填“酸性”“中性”或“碱性”)。
②若有0.1 mol·L-1 Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号)。
A.c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) B.c(Na+)>c(OH-)>c(HA-)>c(A2-)>c(H+)
C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-) D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com