
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题

| A.四种元素最高价氧化物对应的水化物均能与NaOH溶液反应 |
| B.气态氢化物的稳定性:Y<W |
| C.原子半径:Y>Z |
| D.含X的盐溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③④⑤ | B.①③⑤ | C.②④ | D.③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ,下列叙述判断正确的是( )
,下列叙述判断正确的是( )| A.当它可以形成①时,不可能形成④ |
| B.当它可以形成②时,可以形成④ |
| C.当它可以形成①时,不可能形成②和③ |
| D.当它形成②时,也可以形成① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢化物稳定性: HF>H2O>NH3 | B.碱性:LiOH >NaOH>KOH |
| C.酸性:HClO>H2SO4>H3PO4 | D.原子核外电子数:H>O>Al |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接; 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。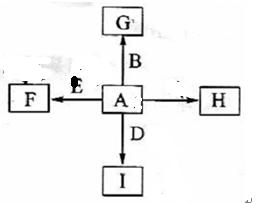
 ;
;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 、D两元素最高价氧化物对应水化物碱性的强弱(填化学式) 。
、D两元素最高价氧化物对应水化物碱性的强弱(填化学式) 。 ________________________________.
________________________________.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com