
【题目】W、X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;W是形成有机物种类最多的元素;R2+的3d轨道中有9个电子。请回答:
(1)Y基态原子的电子排布式是__;Y和W形成的三原子分子是__(填“极性”或“非极性”)分子.
(2)X与氢元素可形成的化合物XH3的中心原子杂化轨道类型为___杂化,XH3的立体构型是___。
(3)Z所在周期中第一电离能最大的主族元素Q名称__。比较沸点高低:XY2__ZY。
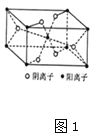
(4)Z与某元素形成的化合物的晶胞如图1所示,晶胞中阴离子与阳离子的个数比是____。
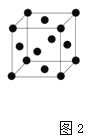
(5)R晶胞结构如图2所示,R晶体中每个R原子周围距离最近的R原子数目为___。
【答案】1s22s22p4 非极性 sp3 三角锥形 氯元素 < 2:1 12
【解析】
W、X、Y、Z、R为前四周期元素,且原子序数依次增大,![]() 是红棕色气体,为
是红棕色气体,为![]() ,则X是N、Y是O元素;X与氢元素可形成
,则X是N、Y是O元素;X与氢元素可形成![]() ;Z基态原子的M层与K层电子数相等,则Z为Mg元素;W是形成有机物种类最多的元素,为C元素;
;Z基态原子的M层与K层电子数相等,则Z为Mg元素;W是形成有机物种类最多的元素,为C元素;![]() 的3d轨道中有9个电子,则R原子核外电子数
的3d轨道中有9个电子,则R原子核外电子数![]() ,为Cu元素。
,为Cu元素。
(1)![]() 为O元素,其基态原子核外有8个电子,根据构造原理书写O基态原子的电子排布式为
为O元素,其基态原子核外有8个电子,根据构造原理书写O基态原子的电子排布式为![]() ;中心重合的分子为非极性分子,不重合的分子为极性分子,Y和W形成的三原子分子为
;中心重合的分子为非极性分子,不重合的分子为极性分子,Y和W形成的三原子分子为![]() ,是直线形分子,该分子中心重合,为非极性分子,
,是直线形分子,该分子中心重合,为非极性分子,
故答案为:![]() ;非极性;
;非极性;
(2)![]() 分子中N原子价层电子对个数是4且含有一个孤电子对,所以该分子中中心原子杂化轨道类型为
分子中N原子价层电子对个数是4且含有一个孤电子对,所以该分子中中心原子杂化轨道类型为![]() 杂化,
杂化,![]() 的立体构型是三角锥形,故答案为:
的立体构型是三角锥形,故答案为:![]() ;三角锥形;
;三角锥形;
(3)![]() 是Mg元素,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,Mg位于第三周期,该周期中第一电离能最大的主族元素是氯元素;熔沸点离子晶体
是Mg元素,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,Mg位于第三周期,该周期中第一电离能最大的主族元素是氯元素;熔沸点离子晶体![]() 分子晶体,
分子晶体,![]() 是分子晶体、MgO是离子晶体,所以熔沸点
是分子晶体、MgO是离子晶体,所以熔沸点![]() ,
,
故答案为:氯元素;![]() ;
;
(4)该晶胞中阳离子个数![]() 、阴离子个数
、阴离子个数![]() ,所以阴阳离子个数之比
,所以阴阳离子个数之比![]() :
:![]() :1,
:1,
故答案为:2:1;
(5)![]() 晶胞为面心立方最密堆积,每个Cu原子周围距离最近的Cu原子数目
晶胞为面心立方最密堆积,每个Cu原子周围距离最近的Cu原子数目![]() ,
,
故答案为:12。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。制取Cl2O的装置如图所示。
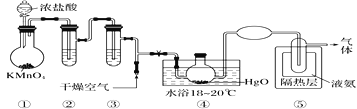
已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃,Cl2O在空气中的百分含量达到25%以上易爆炸;Cl2的沸点为-34.6 ℃;HgO+2Cl2==HgCl2+Cl2O。下列说法中不正确的是
A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料A由两种元素组成,为探究其组成和性质,设计并完成如下实验:

(1) A的化学式为_____________________________________________________。
(2)用化学方程式表示气体C与氯水反应生成D的过程:___________________________________。
(3)B溶于盐酸后生成的物质F可用于净水,结合离子方程式说明其原因:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
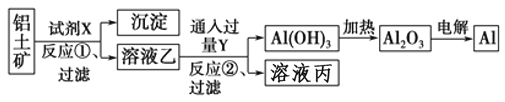
下列叙述正确的是
A. 按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氧化铁
C. 图中所有的转化反应都不是氧化还原反应
D. 反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W 是原子序数依次增大的前四周期元素。其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子。请回答下列问题:
(1)U 在周期表中的位置 。X、Y、Z 的第一电离能从大到小的顺序是 (用元素符号表示,下同)。
(2)写出 W 的价电子排布图 。
(3)根据等电子体原理,可知化合物 XZ 的电子式是 。
(4)X、Y、Z的最简单氢化物的键角从大到小的顺序是 ( 用化学式表示), 原因 是 。
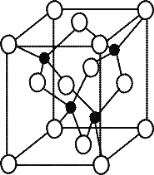
(5)由元素 Y 与 U 元素组成的化合物 A,晶胞结构如右图所示(黑球表示 Y 原子, 白球表示 U 原子),请写出化合物 A 的化学式 ,其中 Y 元素的杂化方式是 。
(6)U 的晶体属立方晶系,其晶胞边长为 405 pm,密度是 2.70 g/cm,通过计算确定 其晶胞的类型 (填简单立方堆积、体心立方堆积或面心立方最密堆 积)(已知:4053≈6.64×107)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、干燥及收集装置如图所示(省略夹持装置和尾气处理装置),仅用此装置和表中提供的物质完成相关实验,合理的是( )
选项 | a中物质 | b中物质 | c中干燥剂 | d收集气体 |
|
A | 浓硫酸 | 亚硫酸钠 | 无水氯化钙 | SO2 | |
B | 稀硫酸 | 大理石 | 无水氯化钙 | CO2 | |
C | 稀硝酸 | 铜片 | 碱石灰 | NO | |
D | 浓氨水 | 熟石灰 | 碱石灰 | NH3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(含有I2、I-等)中回收碘,其实验过程如下:
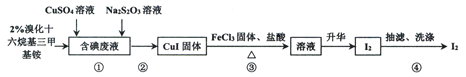
已知:溴化十六烷基三甲基铵是一种阳离子表面活性剂,可以中和沉淀表面所带的负电荷,使沉淀颗粒快速聚集,快速下沉。下列说法不正确的是
A.步骤①中Na2S2O3可用Na2SO3代替
B.步骤②可以用倾析法除去上层清液
C.含碘废液中是否含有IO3-,可用KI-淀粉试纸检验
D.步骤③发生反应的离子方程式为:4Fe3++2CuI![]() 4Fe2++2Cu2++I2
4Fe2++2Cu2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题。
(1)向澄清石灰水中通入过量CO2(写出离子方程式)___________________________________
(2)用稀硫酸洗铁锈(Fe2O3)(写出离子方程式)____________________________________
(3)2Al + 6H+ = 2Al3+ + 3H2↑(写出对应的化学方程式并用双线桥法标出电子转移情况)__________________
(4)在一定条件下,某化合物W受热分解:2W ![]() A↑+2B↑+4C↑,测得反应后生成的混合气体的密度是相同条件下H2密度的12倍,则W的摩尔质量是 _______
A↑+2B↑+4C↑,测得反应后生成的混合气体的密度是相同条件下H2密度的12倍,则W的摩尔质量是 _______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com