
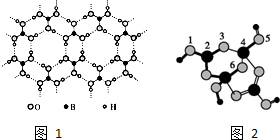
 硼酸晶体具有层状结构,每一层的结构结构如图1所示.
硼酸晶体具有层状结构,每一层的结构结构如图1所示.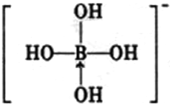 +H+,Y-离子中的配位键可以表示为
+H+,Y-离子中的配位键可以表示为 ,氧元素提供孤对电子给硼元素O→B,
,氧元素提供孤对电子给硼元素O→B, ;
;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑥⑦ | B、②③④⑤ |
| C、④⑤⑥⑦ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol?L-1 |
| B、3 mol?L-1 |
| C、4 mol?L-1 |
| D、8 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molFeCl3完全水解生成Fe(OH)3胶体,其中Fe(OH)3胶粒的个数为NA个 |
| B、25℃时,1L纯水中的H+数目约为10-14NA个 |
| C、1mol/L的盐酸溶液中Cl-的个数为NA个 |
| D、1L 1mol/L的Na2CO3溶液中所含阴离子的总数目大于NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所用NaOH已经潮解 |
| B、向容量瓶中加水未到刻度线 |
| C、有少量NaOH溶液残留在烧杯里 |
| D、用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| B、Na2SO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-) |
| C、NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-) |
| D、浓度均为0.1mol?L-1CH3COOH与CH3COONa溶液等体积混合:2c(H+)-2c(OH-)=c (CH3COO-)-c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com