
| A. | NH4Br的电子式: | B. | S2-的结构示意图: | ||
| C. | 氮气的结构式:N═N | D. | 乙烷的分子式:CH3CH3 |
分析 A.溴离子为阴离子,电子式中需要标出最外层电子及所带电荷;
B.硫离子的核电荷数为16,最外层得到8电子稳定结构;
C.氮气分子中存在的是氮氮三键;
D.乙烷的分子式表示其含有的原子种类及数目,CH3CH3为结构简式.
解答 解:A.溴化铵为离子化合物,阴阳离子需要标出所带电荷及最外层电子,溴化铵正确的电子式为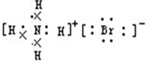 ,故A错误;
,故A错误;
B.S2-的核电荷数是16,核外电子总数为18,期结构示意图为: ,故B正确;
,故B正确;
C.氮气分子中含有氮氮三键,氮气的结构式为N≡N,故C错误;
D.乙烷分子中含有两个甲基,其分子式为:C2H6,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、结构式、分子式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量氯气通入溴化亚铁溶液中2Fe2++2Br-+2Cl2═Fe3++Br2+4Cl- | |
| B. | 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O | |
| C. | 碳酸氢钙和过量的氢氧化钠溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| D. | 用FeCl3溶液腐蚀印刷电路板:Cu+Fe3+=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | d<0 | B. | c<2a+b+d | C. | c=2a+b+d | D. | c>2a+b+d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2MnO4和KMnO4 | B. | CuCO3、Cu(OH)2、Cu2(OH)2CO3 | ||
| C. | NH4NO3和NaNO2 | D. | NaHSO4和Na2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、SO42-、HCO3- | B. | Na+、Ba2+、Cl-、SO42- | ||
| C. | Cu2+、Mg2+、SO42-、NO3- | D. | Fe3+、K+、NO3-、I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com