
【题目】下列关于工业生产的说法正确的是
A. 工业上以氯气和澄清石灰水为原料制造漂白粉
B. 工业上利用H2和Cl2的混合气体在光照下反应来制取盐酸
C. 工业上将氯气溶于NaOH溶液制备漂白粉
D. 漂白粉要干燥和密封保存
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】钛和钛合金在航空工业有着重要应用。冶炼钛的过程中发生的反应之一为:TiO2+2C+2Cl2==TiCl4+2CO。对此,下列说法错误的是
A. C是还原剂 B. TiO2是氧化剂
C. 生成1 mol TiCl4时,转移4 mol电子 D. 尾气必须净化处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为
2NH3+3CuO![]() N2+3Cu+3H2O,试回答:
N2+3Cu+3H2O,试回答:
(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的试验方案。
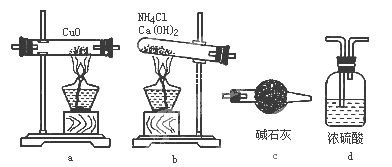
① 仪器连接的顺序(用字母编号表示,仪器可重复使用 )__________;d中浓硫酸的作用是___________,___________________;实验完毕时观察到a中的现象是_____________________;
②列出计算Cu的相对原子质量的表达式__________________;
③下列情况将使测定结果偏大的是_____________。(以下选择填空不限1个正确答案,均用字母标号填写)
A.CuO未全部还原为Cu B.CuO受潮 C.CuO中混有Cu
(2)如果仍采用上述仪器装置,其他方案可选用测定的物理量有___________。
A.m (Cu)和m(CuO) B. m (N2)和m (H2O)
C.m (Cu)和m(H2O) D.m(NH3)和m (H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4+ ____K2SO4+ ____H2O
(2)焦炭可用于制取水煤气。测得12 g碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为______________________________________________________。
(3)工业上在恒容密闭容器中用下列反应合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) △H=akJ/mol 。
CH3OH(g) △H=akJ/mol 。
下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①判断反应达到平衡状态的依据是_____________。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2 mol CO和一定量的H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c![]() mol/L,则以H2表示的反应速率v(H2)=___________。
mol/L,则以H2表示的反应速率v(H2)=___________。
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的
混合气为正极助燃气,制得在650 ℃下工作的燃料电池,其正极反应式:
O2+ 2CO2+4e-=2CO32-,则负极反应式:______________________________________。
(5)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq) ![]() BaCO3(s)+SO42-(aq)。已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=___________。
BaCO3(s)+SO42-(aq)。已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁粉、铜粉混合物样品11.6 g,逐滴加入2.0 mol·L-1的硫酸溶液,充分反应后剩余固体质量随加入硫酸溶液体积变化如下表:
硫酸溶液/mL | 20.0 | 40.0 | 60.0 | 80.0 |
剩余固体/g | 9.36 | 7.12 | 4.88 | 3.20 |
请回答:
(1)样品中铁与铜的物质的量之比n(Fe)∶n(Cu)=________。
(2)在反应后的体系中,再加入4.0 mol·L-1的H2O2溶液25.0 mL,并加入足量硫酸溶液。充分反应后溶液中存在的各金属离子的物质的量分别是多少?__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为最简单的烯烃,高分子材料PET聚酯树脂和PMMA的合成路线如下:

相关信息如下:
Ⅰ.RCOOR′+R″18OH ![]() RCO18OR″+R′OH(R、R′、R″代表烃基)
RCO18OR″+R′OH(R、R′、R″代表烃基)
Ⅱ.  (R、R′代表烃基)请回答下列问题:
(R、R′代表烃基)请回答下列问题:
(1)下列说法正确的是________(填字母)。
A.化合物F能发生银镜反应
B.化合物E与化合物D互为同系物
C.化合物G能发生缩聚反应生成聚酯
D.1 mol PMMA与足量NaOH溶液反应最多消耗1 mol NaOH
(2)已知![]() 的同分异构体有多种,写出同时满足下列条件的同分异构体______________________________________________________________。
的同分异构体有多种,写出同时满足下列条件的同分异构体______________________________________________________________。
①能以物质的量之比1∶2与NaHCO3溶液发生反应;
②红外光谱表明分子中含有一个“—CH3”;
③1HNMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子。
(3)PET单体的结构简式为 ________________。
(4)D+I―→PMMA单体的化学方程式为__________________________________________________。
(5)完成A―→B的合成路线(用流程图表示,无机试剂任选)。
_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ag2SO4的Ksp为2.0×10-5 mol3·L-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+ 和SO42-浓度随时间变化关系如右图[饱和Ag2SO4溶液中c(Ag+)=0.034 molL-1]。若t1时刻在上述体系中加入100 mL 0.020 molL-1 Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+ 和SO42-浓度随时间变化关系的是



A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com