
【题目】为了将可称量的物质与难以称量的微观粒子之间联系起来,国际上采用了“物质的量”这一物理量,据此完成下列试题:
(1)等质量的O2和O3所含分子的物质的量之比为___。
(2)等温等压下,等体积的O2和O3所含分子个数比为___,质量比为___。
(3)设NA为阿伏加德罗常数的值,如果ag氧气中含有的分子数为b,则cg氧气在标准状况下的体积约是___(用含a、b、c、NA的式子表示)。
(4)实验室需要配制100mL1mol/L的NaOH溶液,进行如下操作:
①配制该溶液所需主要仪器除了托盘天平、玻璃棒、烧杯、胶头滴管,还需要的玻璃仪器___。
②计算需要NaOH固体的质量:___g。
③取出50 mL配制好的溶液,此溶液中NaOH的物质的量浓度为___。
④若出现如下情况,导致所配溶液浓度偏高的是___。
A.称量时砝码已经生锈
B.定容时仰视
C.溶解、转移溶液之后没有对烧杯和玻璃棒进行洗涤操作
D.定容摇匀后,液面低于容量瓶颈上的刻度线
【答案】3:2 1:1 2:3 ![]() L 100mL容量瓶 4.0 1mol/L A
L 100mL容量瓶 4.0 1mol/L A
【解析】
(1)根据![]() 可知,等质量的O2和O3的物质的量之比为
可知,等质量的O2和O3的物质的量之比为![]() ,所含分子的物质的量之比为3:2。
,所含分子的物质的量之比为3:2。
(2)根据阿伏加德罗定律,PV=nRT(R为常数),在等温等压下,等体积的任一气体所含分子的物质的量相同,由N=nNA(NA为常数)可知,分子个数比为1:1;由m=nM 可知,O2和O3的质量比为2:3。
(3)设NA为阿伏加德罗常数的值,如果ag氧气中含有的分子数为b,则ag氧气的物质的量![]() ,摩尔质量
,摩尔质量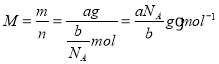 ,即当氧气为cg,物质的量
,即当氧气为cg,物质的量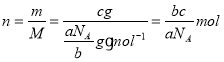 ,在标准状况下的体积
,在标准状况下的体积![]() L。
L。
(4)①实验室需要配制100mL1mol/L的NaOH溶液,则配制该溶液所需主要仪器为托盘天平、玻璃棒、烧杯、胶头滴管和100mL容量瓶 。
②需要NaOH固体的质量![]() 。
。
③溶液具有均一性,物质的量浓度不随着溶液的体积发生改变,浓度仍然为1mol/L。
④A.称量时砝码已经生锈,实际砝码质量增大,称得的氢氧化钠质量增大,浓度偏高;
B.定容时仰视,实际加水量偏高,溶液浓度偏低;
C.溶解、转移溶液之后没有对烧杯和玻璃棒进行洗涤操作,剩余部分溶质残留,导致容量瓶内部溶质减小,溶液物质的量浓度偏低;
D.定容摇匀后,溶液物质的量浓度固定,液面低于容量瓶颈上的刻度线对结果无影响。
答案为A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知 SO32ˉ+I2+H2O= SO42ˉ+2Iˉ+2H+,将 0.09molCl2通入 100mL 含 a molNaI与 a mol Na2SO4的混合溶液中,有 0.25a mol的 NaI 被氧化(不考虑 Cl2 与 I2 之间的反应),则下列说法正确的是
A.物质的还原性 Iˉ >SO32ˉ
B.NaI 与 Na2SO3 的物质的量浓度为 0.08mol/L
C.通入 0.09molCl2 发生反应的离子方程式为:8SO32ˉ+2Iˉ+9Cl2+8H2O=8SO42ˉ+I2+16H++18Clˉ
D.若再通入0.07molCl2,恰好能将 NaI与 Na2SO3 完全氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、![]() 的摩尔电导率分别为0.60、1.98、0.45据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
的摩尔电导率分别为0.60、1.98、0.45据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
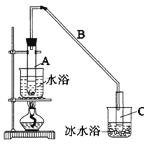
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: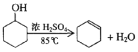
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是:_______________,导管B除了导气外还具有的作用是:_______________。
②试管C置于冰水浴中的目的是。:_______________
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在:_______________层(填上或下),分液后用:_______________ (填入编号)洗涤。
a.KMnO4溶液b.稀H2SO4c.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的结构及性质说法错误的是( )
A.2-丁烯是石油裂解的产物之一,它存在顺反异构
B.乙酸、苯酚、乙醇都可以与金属钠反应产生氢气,所以它们都是电解质
C.该有机物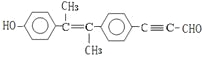 中,最多有19个碳原子共面
中,最多有19个碳原子共面
D.甲苯的硝化反应能说明侧链对苯环的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,如合成的金刚烷胺就是一种抗病毒药剂,对帕金森症、老年痴呆有良好的疗效.由环戊二烯合成金刚烷的路线如下:
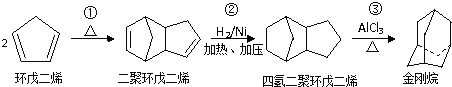
请回答下列问题:
(1)金刚烷的分子式为 ______ .
(2)反应①的反应类型是 ______ .
(3)金刚烷与四氢二聚环戊二烯的关系是 ______ .(填字母)
a 互为同系物 b 互为同分异构体 c 均为烷烃 d 均为环烃
(4)下面是以环戊烷为原料制备环戊二烯的合成路线:
![]()
其中,反应②的反应试剂和反应条件是 ______ ;X的名称是 ______ ;反应④的化学方程式是 ______ ;
(5)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸[提示:苯环上的烷基(-CH3、-CH2R、-CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基],则A的结构有 ______ 种(不考虑立体异构),其中核磁共振氢普为5组峰,且面积比为4:1:2:2:3的结构简式是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)今有如图所示的三种有机物:
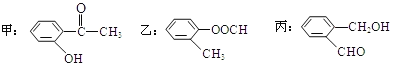
①写出丙中含氧官能团的名称___;
②这三种物质中,互为同分异构体的是___;
(2)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
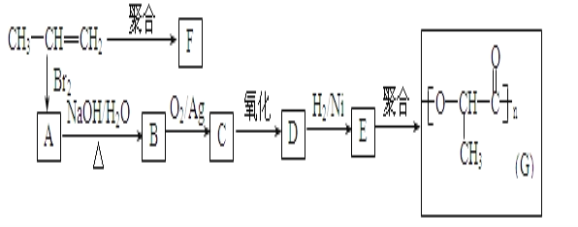
①A的同分异构体还有___种;
②聚合物F的结构简式是___;
③B转化为C的化学方程式是___;
④写出与E具有相同官能团的一种同分异构体的结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
(1)把氯气通入紫色石蕊溶液中,可以观察到的现象是_________;
(2)氯气与水反应生成次氯酸(HClO)具有杀菌作用,常用于自来水消毒。请写出氯气与水反应的化学方程式:___________,在该反应中氧化产物是_________,还原产物是____________。
(3)某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液。其反应原理为(用化学方程式表示):_________。
(4)某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用:
①该同学应称取NaOH固体__________ g;
②上述实验除了需要托盘天平、药匙、烧杯、玻璃棒、量筒等仪器外,还需要的仪器有_______。
③下列操作使配制的NaOH溶液浓度偏低的有__________。
A.将砝码放在左盘上,NaOH放在右盘上进行称量
B.定容的仰视刻度线
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
(5)取上述配制的NaOH溶液______ L才能与0.224 L 氯气(标准状况下)恰好完全反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是
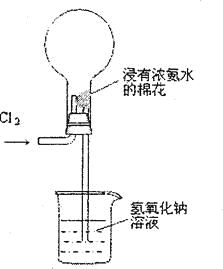
A.烧瓶中立即出现白烟
B.烧瓶中立即出现红棕色
C.烧瓶中发生的反应表明常温下氨气有还原性
D.烧杯中的溶液是为了吸收有害气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com