
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | A、B | A、C | A、D | C、D |
| 1mol×22.4L/mol |
| 5.6L |


科目:高中化学 来源: 题型:
| A、只有①③ | B、除②④⑥ |
| C、只有②⑤ | D、除④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
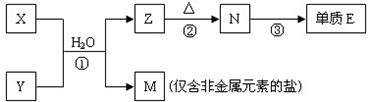
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
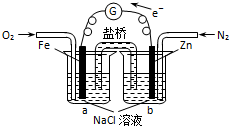 根据如图,下列判断中正确的是( )
根据如图,下列判断中正确的是( )| A、该装置将电能转化为化学能 |
| B、烧杯a中的溶液pH降低 |
| C、Fe电极发生了氧化反应 |
| D、烧杯b中发生的反应为Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=4的醋酸溶液c(H+)=1×10-4mol/L |
| B、加热0.1mol/L的稀醋酸溶液时PH值减小 |
| C、10mL 1mol/L的醋酸恰好与10mL 1mol/L NaOH溶液完全中和 |
| D、将Vml pH=4的醋酸稀释成pH=5的溶液,所需加入的水量大于10Vml |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com