
 ��3����֪һ����̼��ˮ�����ķ�ӦΪ��CO(g)��H2O(g) CO2(g)��H2(g)
��3����֪һ����̼��ˮ�����ķ�ӦΪ��CO(g)��H2O(g) CO2(g)��H2(g)| ʱ�� / min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
 H2(g)�� CO2 (g)
H2(g)�� CO2 (g)

 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 bB(g)
bB(g)| A��ƽ��������Ӧ���������ƶ� | B��A ���ʵ�ת���ʱ�С�� |
| C��B ���ʵ��������������� | D��a��b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 3C��g��+2D(g) ��H��0,��������ڵķ�Ӧ�ﵽ��ѧƽ�⣬A��Ũ��Ϊ2.4mol��L-1��B��Ũ��Ϊ1.8mol��L-1��tmin���������ﵽ��ѧƽ�⣬B��Ũ��Ϊ0.8mol��L-1��������Ŀ������Ϣ�ش���������:
3C��g��+2D(g) ��H��0,��������ڵķ�Ӧ�ﵽ��ѧƽ�⣬A��Ũ��Ϊ2.4mol��L-1��B��Ũ��Ϊ1.8mol��L-1��tmin���������ﵽ��ѧƽ�⣬B��Ũ��Ϊ0.8mol��L-1��������Ŀ������Ϣ�ش���������:�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 pC������+qD������+ Q�������жϣ�������ȷ����
pC������+qD������+ Q�������жϣ�������ȷ���� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��5.75 | B��11.5 | C��23 | D��46 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
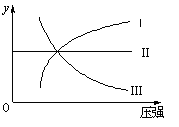
 2NH3(g) ��H��0�����ߢ�
2NH3(g) ��H��0�����ߢ�  2HI(g) ��H��0�����ߢ�
2HI(g) ��H��0�����ߢ� 2SO2(g)+O2(g) ��H��0�����ߢ�
2SO2(g)+O2(g) ��H��0�����ߢ�| A���٢ڢ� | B���٢ڢ� | C���٢ۢ� | D���ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ѧ��Ӧ���ʣ��ң��� | B��ƽ��ʱO2��Ũ�ȣ��ң��� |
| C��SO2��ת���ʣ��ף��� | D��ƽ��ʱSO2������������ף��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z�����ﵽ��ѧƽ��ʱ����Ӧ�������ʵ����������������ʵ�����ȣ���ʱx��ת������( )��
2Z�����ﵽ��ѧƽ��ʱ����Ӧ�������ʵ����������������ʵ�����ȣ���ʱx��ת������( )��| A��70% | B��60% | C��50% | D��40% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2AB(g)�ﵽƽ��ı�־��
2AB(g)�ﵽƽ��ı�־��| A����λʱ������n mol��A2ͬʱ����n mol��AB |
| B�������ڵ���ѹǿ����ʱ��仯 |
| C����λʱ������2n mol��ABͬʱ����n mol��B2 |
| D����λʱ������n mol��A2ͬʱ����n mol��B2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com