
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ? | ? |
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高一版(必修1) 2009-2010学年 第4期 总第160期 人教课标版 题型:013
|
下列实验问题的表述不正确的是 | |
| [ ] | |
A. |
普通漏斗、蒸馏烧瓶、分液漏斗是高中化学实验中常用的分离仪器 |
B. |
实验室用H2还原CuO,当反应完毕时应持续通入H2一段时间 |
C. |
发现有人一氧化碳中毒时,立即将其转移到通风的地方救治 |
D. |
在萃取碘水中碘的实验时,注入碘水和萃取剂,倒转分液漏斗,反复用力震荡后立即分液 |
查看答案和解析>>
科目:高中化学 来源:2012届济南市高二第二学期期末考试化学试卷(理科) 题型:填空题
(8分)
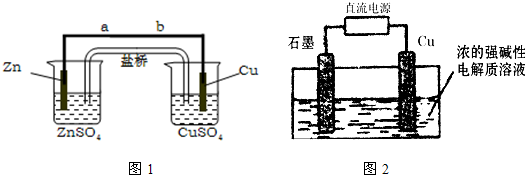
某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。
|
|
(1)写出装置中锌电极上的电极反应式: ;
(2) 若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为 ;
(用“NA”表示)
(3) 装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的
K+、Cl-的移动方向表述正确的是 。
A. 盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B. 盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C. 盐桥中的K+、Cl-都向右侧烧杯移动
D. 盐桥中的K+、Cl-几乎都不移动
(4) 若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B. Zn C. Fe D. H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com