
【题目】高铁酸钠(Na2FeO4)是一种新型、高效的水处理剂,与水反应的化学方程式为:4Na2FeO4+10H2O=4Fe(OH)3+3O2↑+8NaOH。电解制备 Na2FeO4 装置示意图如下。

(1)a是电源的______________极(填“正”或“负”)。电解时,石墨电极附近溶液的碱性____________(填“增强”、“减弱”或“不变”)。
(2)铁电极的反应式为__________________________。
(3)维持一定的电流强度和电解温度,NaOH起始浓度对Na2FeO4浓度影响如下图(电解液体积相同情况下进行实验)。

①电解3.0h内,随NaOH起始浓度增大,Na2FeO4浓度变化趋势是______________(填“增大”、“不变”或“减小”)。
②当NaOH起始浓度为16mol·L-1,1.0~2.0h内生成Na2FeO4的速率是_____________mol·L-1·h-1。
③A 点与B 点相比,n[Fe(OH)3]: A_____________B (填“>”、 “=”或“<” )
(4)提纯电解所得Na2FeO4,采用重结晶、过滤、洗涤、低温烘干的方法,则洗涤剂最好选用______________溶液(填标号)和异丙醇。
A.Fe(NO3)3 B.NH4Cl C.CH3COONa
(5)次氯酸钠氧化法也可以制得Na2FeO4。
己知 2H2(g)+O2(g)=2H2O (1) △H=akJ·mol-1
NaCl(aq)+ H2O(1)=NaClO(aq)+H2(g) △H=bkJ·mol-1
4Na2FeO4(aq)+10H2O(1)=4Fe(OH)3(s)+3O2(g)+8NaOH(aq) △H=c kJ·mol-1
反应 2Fe(OH)3(s)+3NaClO(aq)+4NaOH(aq)=2Na2FeO4(aq)+3NaCl(aq)+5H2O(1)的△H=______________ kJ·mol-1。
【答案】 负 增强 Fe+8OH--6e-=FeO42-+4H2O 增大 8 < C -![]() a - 3b-
a - 3b-![]() c
c
【解析】(1)应该用铁做阳极电解氢氧化钠制备铁酸钠,电解时铁失去电子发生氧化反应结合氢氧根离子生成铁酸跟离子和水,电极反应式为:Fe+8OH--6e-=FeO42-+4H2O;因此a是电源的负极,b为电源的正极,电解时,石墨电极为阴极,阴极发生还原反应,电极方程式为2H2O+2e-=H2↑+2OH-,石墨电极附近溶液的碱性增强,故答案为:负; 增强;
(2)根据上述分析,铁电极的反应式为Fe+8OH--6e-=FeO42-+4H2O,故答案为:Fe+8OH--6e-=FeO42-+4H2O;
(3)①根据图像,电解3.0h内,随NaOH起始浓度增大,Na2FeO4浓度逐渐增大,故答案为:增大;
②根据图像,当NaOH起始浓度为16mol·L-1,1.0~2.0h内生成Na2FeO4的速率=![]() =8mol·L-1·h-1,故答案为:8;
=8mol·L-1·h-1,故答案为:8;
③根据图像,A 点与B 点相比,Na2FeO4浓度A>B,根据铁元素守恒,n[Fe(OH)3]: A<B,故答案为:<;
(4)A.Fe(NO3)3溶液能够溶解Na2FeO4,不选;B.NH4Cl溶液能够溶解Na2FeO4,不选;C.CH3COONa电离出的钠离子能够抑制Na2FeO4的溶解,可以选择;故选C;
(5)①2H2(g)+O2(g)=2H2O (1) △H=akJ·mol-1 ,②NaCl(aq)+ H2O(1)=NaClO(aq)+H2(g) △H=bkJ·mol-1,③4Na2FeO4(aq)+10H2O(1)=4Fe(OH)3(s)+3O2(g)+8NaOH(aq) △H=c kJ·mol-1 。根据盖斯定律,将①×(-![]() )-②×3-③×
)-②×3-③×![]() ,得:2Fe(OH)3(s)+3NaClO(aq)+4NaOH(aq)=2Na2FeO4(aq)+3NaCl(aq)+5H2O(1) △H=-
,得:2Fe(OH)3(s)+3NaClO(aq)+4NaOH(aq)=2Na2FeO4(aq)+3NaCl(aq)+5H2O(1) △H=-![]() -3b-
-3b-![]() kJ·mol-1,故答案为:-
kJ·mol-1,故答案为:-![]() -3b-
-3b-![]() 。
。


科目:高中化学 来源: 题型:
【题目】(1)写出下列化合物的名称或结构简式:
① _______________________________,
_______________________________,
②CH2=C(CH3)CH=CH2_______________________________,
③CH2=CHCOOH _______________________________,
④2,5-二甲基-2,4-己二烯的结构简式:_________________________________。
(2)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱,经我国科学家研究发现其结构如图:

①麻黄素中含氧官能团的名称是_________________,属于____________类(填“醇”或“酚”)。
②下列各物质:
A. 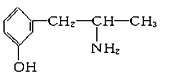 B.
B. 
C.  D.
D. 
E. 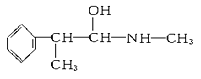
与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.铁跟氯化铁溶液反应: Fe + 2Fe3+→3Fe2+
B.氨水跟盐酸反应: OH-+ H+→ H2O
C.氢氧化钡跟稀硫酸反应: Ba2++ OH-+ H++ SO42-→ BaSO4↓+ H2O
D.碳酸钙跟盐酸反应: CO32-+2H+→CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.若反应X+Y===M是放热反应,该反应一定不用加热
B.需要加热方能发生的反应一定是吸热反应
C.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应
D.1 mol硫酸与足量氢氧化钠发生中和反应生成水所释放的能量称为中和热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知常温下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.01 molL-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示。 已知100.4=2.5,下列说法错误的是

A. n=7
B. 水的电离程度先增大再减小
C. 常温下醋酸的电离常数约是1.67×10-5
D. Y点溶液中c(NH3·H2O)+c(OH-)=c(CH3COO-)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com