
【题目】用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升。下列分析错误的是

A.Al和O2化合放出热量B.硝酸汞是催化剂
C.涉及了:2Al+3Hg2+→2Al3++3HgD.“白毛”是氧化铝
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
![]()
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差3
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种防止血栓形成与发展的药物J的合成路线如图所示(部分反应条件略去):
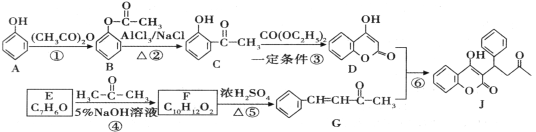
回答下列问题:
(1)A中官能团的名称是________________,反应⑤的反应类型是_________________。
(2)J的分子式是_______________。F的结构简式是________________________。
(3)反应③的化学方程式为________________________。
(4)已知C有多种同分异构体。写出同时满足下列条件的C的同分异构体的结构简式______(只需写出两个):
①苯环上有两个处于对位上的取代基;②1mol该有机物与足量金属钠反应生成1g氢气。
(5)请参照J的合成方法,写出以![]() 为原料制备
为原料制备 的合成路线:
的合成路线:
___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应2A+3B![]() C+2D的化学反应速率与化学平衡随外界条件改变而变化的情况,由此可推断( )
C+2D的化学反应速率与化学平衡随外界条件改变而变化的情况,由此可推断( )
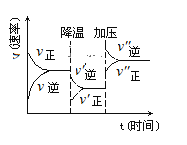
A.正反应是放热反应
B.逆反应是吸热反应
C.若C、D是气体,则B是液体或固体
D.A、B、C、D均为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南京大学研究发现TiO2-x晶体中存在的晶体缺陷有利于提高导电性和提供镁离子储位,可用作新型镁电池负极材料,该电池的工作原理如图所示。下列说法正确的是( )
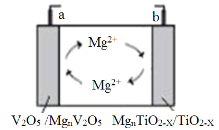
A.放电时,a为电池负极
B.充电时,Mg2+向b电极移动
C.放电时,a极的电极式为nMg2++V2O5+2ne-=MgnV2O5
D.充电时,b极的电极式为MgnTiO2-x-2ne-=nMg2++TiO2-x
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某浓度的H2A溶液中滴加NaOH溶液,若定义pc=-lgc,则测得pc(H2A)、pc(HA-)、pc(A2-)变化如图所示。下列说法错误的是( )
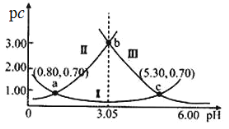
A.pH=3时溶液中c(A2-)>c(H2A)>c(HA-)
B.常温下,H2A的Ka1=10-0.80,Ka2=10-5.30
C.NaHA溶液中c(H+)>c(OH-)
D.从a点到c点,![]() 先增大后减小
先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年国际非政府组织“全球计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋缓。CO2的综合利用是解决温室问题的有效途径。
(1)CO2催化加氢制甲醇的有关反应及其在不同温度下的化学平衡常数如下表所示。
化学反应 | 平衡常数 | ||
500℃ | 700℃ | 800℃ | |
Ⅰ.H2(g)+CO2(g) H2O(g)+CO(g) | 1.0 | 1.70 | 2.52 |
Ⅱ.2H2(g)+CO(g) CH3OH(g) | 2.5 | 0.34 | 0.15 |
Ⅲ.3H2(g)+CO2(g) CH3OH(g)+H2O(g) ΔH | |||
①ΔH___0(填“>”、“<”或“=”)。
②已知反应Ⅲ的速率方程式:υ正=k正·c3(H2)·c(CO2),υ逆=k逆·c(CH3OH)·c(H2O),k正、k逆为速率常数。反应达到平衡后,仅升高温度,k正增大的倍数___k逆增大的倍数(填“大于”、“小于”或“等于”)。
③500℃时,向恒容的密闭容器中加入1molCO2和1molH2,控制反应条件只发生反应Ⅰ。达到平衡后,只改变下列条件,能使CO的平衡体积分数增大的是___(填选项字母)。
A.增大压强 B.降低温度 C.再通入等物质的量CO2和H2 D.分离出部分水
(2)在200℃时,向5L带气压计的恒容密闭容器中通入2molCO2和2molCH4发生反应CH4(g)+CO2(g)2H2(g)+2CO(g),测得初始压强为P0kPa,反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示。
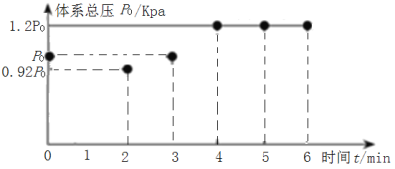
①该反应过程中从0min到2min压强变化原因是___。
②0~4min内,反应的平均反应速率υ(CO2)=___。
③用平衡分压代替平衡浓度表示的化学平衡常数Kp=___。[气体分压(p分)=气体总压(p总)×气体体积分数]
(3)科学家提出利用CO2与CH4制备“合成气”(CO、H2)可能的反应历程如图所示。
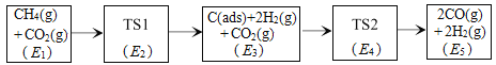
注:C(ads)为吸附性活性炭,方框内包含微粒种类及数目、微粒的相对总能量[如第一个方框中1个CH4(g)+1个CO2(g)的相对总能量为E1eV,单位:eV]。其中,TS表示过渡态。
①CH4(g)+CO2(g) 2H2(g)+2CO(g)ΔH=___kJ·mol-1(已知:1eV=1.6×10-22kJ)
②若E4+E1<E3+E2,则决定制备“合成气”反应速率的反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,合理的是( )。

A. 图①:验证H2CO3酸性强于H2SiO3 B. 图②:收集CO2或NH3
C. 图③:分离Na2CO3溶液与CH3COOC2H5 D. 图④:分离C2H5OH与CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】借助太阳能将光解水制H2与脱硫结合起来,既能大幅度提高光解水制H2的效率,又能脱除SO2,工作原理如下图所示。下列说法不正确的是
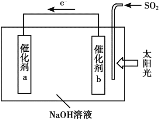
A. 该装置可将太阳能转化为化学能
B. 催化剂b附近的溶液pH增大
C. 吸收1mol SO2,理论上能产生1mol H2
D. 催化剂a表面发生的反应为:2H2O+2e-=H2↑+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com