
| 选项 | X溶液 | 物质Y |
| A | CuCl2 | 1mol Cu(OH)2 |
| B | KOH | 1mol KOH |
| C | Na2SO4 | 1mol H2SO4 |
| D | AgNO3 | 0.5mol Ag2O |
| A. | A | B. | B | C. | C | D. | D |
分析 根据电解原确定电解后析出的金属或是放出的气体,根据:出什么加什么,出多少加多少的原理确定电解质复原加入的物质以及量的多少.
A、电解氯化铜,在两极上分别产生金属铜和氯气;
B、电解氢氧化钾的实质是电解水;
C、电解硫酸钠的实质是电解水;
D、电解硝酸银两极上产生的是金属银和氧气,根据元素守恒确定加入的物质的量的多少.
解答 解:A、电解氯化铜,在两极上分别产生金属铜和氯气,电解质复原加入氯化铜即可,故A错误;
B、电解氢氧化钾的实质是电解水,所以电解质复原加入水即可,故B错误;
C、电解硫酸钠的实质是电解水,所以电解质复原加入水即可,故C错误;
D、电解硝酸银两极上产生的是金属银和氧气,所以电解质复原加氧化银即可,电解含1mol溶质硝酸银的溶液,会析出金属银1mol,根据银元素守恒,所以加入0.5mol Ag2O后即可复原,故D正确;
故选D.
点评 本题考查学生电解池的工作原理以及电解质复原的方法,注意“出什么加什么,出多少加多少”的原理的应用是关键,难度中等.


科目:高中化学 来源: 题型:解答题
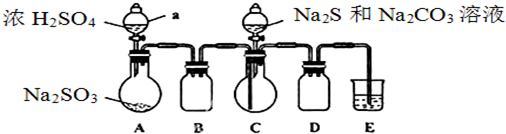
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6mol/L | B. | 1mol/L | C. | 1.2mol/L | D. | 0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6L | B. | 6.72L | C. | 8.4L | D. | 2.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列实验操作正确的是( )
下列实验操作正确的是( )| A. | 可用磨口玻璃瓶保存NaOH溶液 | |
| B. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| C. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| D. | 用装置乙加热分解NaHCO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫能使溴水褪色,说明二氧化硫具有漂白性 | |
| B. | 漂白粉和明矾都常用于处理自来水,二者的作用的原理相同 | |
| C. | 检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可用酸性高锰酸钾溶液 | |
| D. | 金属单质Na、Al、Fe在一定条件下与水反应都生成氢气和对应的碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.lmo/L的H2S溶液中:c(HS-)+c(S2-)=0.lmo/L | |
| B. | 常温下,100 mL pH=2的盐酸与10 mL pH=13的NaOH溶液混合,所得溶液pH=7 | |
| C. | 0.lmo/L CH3COOK溶液和0.lmo/L KOH溶液等体积混合,混合溶液中浓度大小关系是:c(K+)>c(CH3COO-)>c (OH-)>c(CH3COOH) | |
| D. | 0.lmo/L的三种溶液:①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2 Fe(SO4) 2 其c(NH4+)从大到小的顺序为:③②① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com