
120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A.2.0mol·L-1 B.1.5 mol·L-1 C.0.18 mol·L-1 D.0.24 mol·L-1
科目:高中化学 来源: 题型:
2008年5月17日新疆电视台(午间新闻)报道我国新增阿勒泰大气背景监测点。这标志着气候条件独特、空气质量优良的新疆阿勒泰市已成为我国第8个国家大气背景监测点。监测点安装的监测设备可监测日常二氧化硫、二氧化氮、一氧化氮等污染物。NO分子因污染空气而臭名昭著,近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。请回答下列问题:
(1)NO对环境的危害在于________(填编号)。
A.破坏臭氧层
B.高温下能使一些金属氧化
C.造成酸雨
D.与人体血红蛋白结合
(2)在含Cu+的酶的活化中心,亚硝酸根离子(NO)可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:_________________________________________。
(3)“绿色奥运”是2008年北京奥运会的主题之一,为迎接奥运,减少空气污染,北京为汽车加装了“三效催化净化器”,可将尾气中的一氧化碳和一氧化氮转化为参与大气循环的无毒混合气体,该气体是( )
A.二氧化碳和氮气 B.二氧化碳和二氧化氮
C.二氧化碳和氧气 D.二氧化碳和氢气
(4)氟利昂(如CCl2F2)可在光的作用下分解,产生氯原子,氯原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应如下:
O3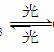 O2+O Cl+O3ClO+O2 ClO+OCl+O2 总反应:2O3===3O2
O2+O Cl+O3ClO+O2 ClO+OCl+O2 总反应:2O3===3O2
在上述臭氧变成氧气的过程中,Cl是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在4℃时,100 mL水中溶解了 22.4 L HCl气体(标准状况下测得)后形成溶液。下列说法正确的是( )
A.该溶液物质的量浓度为10 mol/L
B.该溶液物质的量浓度因溶液的密度未知而无法求得
C.该溶液中溶质的质量分数因溶液的密度未知而无法求得
D.所得溶液的体积为22.5 L
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol
现将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中,测得H2的物质的量随时间变化如图中实线所示(图中字母后括号内的数对表示对应的坐标):
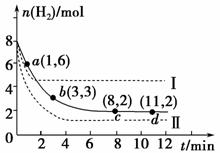
回答下列问题:
(1)由图分析,在下列时间段内反应速率最快的是______(填序号)。
a.0~1 min B.1~3 min
c.3~8 min D.8~11 min
(2)仅改变某一条件再进行实验,测得H2的物质的量随时间的变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是________________,曲线Ⅱ改变的条件可能是________________。
(3)下列表述能表示该反应已达平衡的是________(填序号)。
a.容器内压强不再改变
b.容器内气体的密度不再改变
c.容器内气体的平均摩尔质量不再改变
d.容器内各物质的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解400 mL一定浓度的硫酸铜溶液(不考虑电解过程中溶液体积的变化),通电一段时间后,如果向所得的溶液中加入0.05 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和体积(不考虑CO2的溶解),电解过程中转移的电子物质的量为( )
A.0.2 mol
B. 0.3mol
C. 0.4 mol
D. 0.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液:Ca2+、H+、Cl-、HSO B.能使pH试纸呈红色的溶液:Na+、NH
B.能使pH试纸呈红色的溶液:Na+、NH 、I-、NO
、I-、NO
C.FeCl2溶液:K+、Na+、SO 、AlO
、AlO D.
D. =0.1 mol·L-1的溶液:Na+、K+、SiO
=0.1 mol·L-1的溶液:Na+、K+、SiO 、NO
、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质
LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,生成 LiMnO2。回答下列问题:
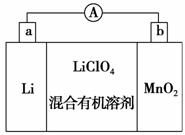
(1)外电路的电流方向是由________极流向________极。
(填字母)
(2)电池正极反应式为_____________________________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是______________________________________________________。
(4)MnO2 可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为___________________________________________________________。
K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于粒子结构的描述不正确的是 ( )。
A.H2S 和 NH3 均是价电子总数为8的极性分子
B.HS -和 HCl 均是含一个极性键的 18 电子粒子
C.CH2Cl2 和 CCl4 均是四面体构型的非极性分子
D.NCl3 是含极性键的极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com