
| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | 第三周期元素的离子半径从左到右逐渐减小 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | ⅣA族元素的氢化物中,稳定性最好的是CH4 |
分析 A.ⅠA族元素的金属性不一定比ⅡA族元素的金属性强;
B.第三周期的阳离子比阴离子少1个电子层,则阳离子半径大于阴离子;
C.同周期非金属元素最高价氧化物的水化物酸性从左到右依次增强;
D.非金属性越强,氢化物的稳定性越强.
解答 解:A.同一周期中,ⅠA族元素的金属性比ⅡA族元素的金属性强,若不在同一周期,ⅡA族元素的金属性可能大于ⅠA族元素,如Ca的金属性大于Na、Li,故A错误;
B.电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小,则第三周期元素离子半径大小顺序为:P3->S2->Cl->Na+>Mg2+>Al3+,故B错误;
C.同周期非金属元素最高价氧化物的水化物酸性从左到右依次增强,但低价态氧化物的水化物酸性不一定如此,如H2SO4的酸性比HClO强,故C错误;
D.ⅣA族元素中,非金属性最强的为C,非金属性越强,氢化物越稳定,则氢化物稳定性最好的是CH4,故D正确;
故选D.
点评 本题考查同主族、同周期元素性质及元素化合物性质,为高频考点,把握同主族、同周期的位置关系及非金属性比较为解答的关键,注意掌握元素周期律的内容.


科目:高中化学 来源: 题型:解答题
 氮元素可形成卤化物、叠氮化物及络合物等.
氮元素可形成卤化物、叠氮化物及络合物等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉在水里形成的透明液体 | |
| B. | 氧化钴(Co2O2)分散在普通玻璃里形成蓝色有机玻璃 | |
| C. | 饱和FeCl3溶液滴入沸水中所形成的红褐色液体 | |
| D. | 将0.1g蔗糖加到10mL蒸馏水中,振荡后形成的无色液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电极B为正极,CO2在正极发生还原反应 | |
| B. | 电极A上H2参与的电极反应为:H2+CO32--2e-=CO2↑+H2O | |
| C. | 电极B上发生的电极反应为:4H++O2+4e-=2H2O | |
| D. | 电池工作时,CO32-向电极B移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式3s23p5.C原子结构示意图
B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式3s23p5.C原子结构示意图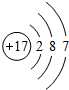
 ,结构式
,结构式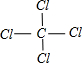 ,中心原子Asp3杂化,立体构型是非极性 (填“极性”或“非极性”)分子.
,中心原子Asp3杂化,立体构型是非极性 (填“极性”或“非极性”)分子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有效地利用现有新能源和开发新能源已受到各国的重视.
有效地利用现有新能源和开发新能源已受到各国的重视.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:25℃时某些弱酸的电离平衡常数.下面图象表示常温下稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是( )
已知:25℃时某些弱酸的电离平衡常数.下面图象表示常温下稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10 -5 | Ka=3.0×10 -8 | Ka1=4.1×10 -7 Ka2=5.6×10 -11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度大小关系为:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通少量CO2的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c(R-)}{c(HR)•c(OH-)}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度等于b点酸的总浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com